
【题目】(1)工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g) ===CH3OH(g) ΔH=-90.8 kJ·mol-1。在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。
如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是__________。



(2)如图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
Ⅰ.甲中负极的电极反应式为__________________________。
Ⅱ.乙中反应的化学方程式为_________________________________;A极析出的气体在标准状况下的体积为________。
Ⅲ.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要______ mL 5.0 mol·L-1 NaOH溶液。
【答案】270 ℃ Ⅰ.CH3OH-6e-+8OH-===![]() +6H2O 2CuSO4+2H2O===2Cu+O2↑+2H2SO4,2H2O===O2↑+2H2↑ 2.24 L Fe2+ 280
+6H2O 2CuSO4+2H2O===2Cu+O2↑+2H2SO4,2H2O===O2↑+2H2↑ 2.24 L Fe2+ 280
【解析】
(1)该反应是放热反应,升高温度,平衡逆向移动,转化率减小,因此Z为270 ℃。
(2)Ⅰ.甲中燃料为负极,氧化剂为正极,因此甲醇为负极,在碱性条件下失去电子变为碳酸根和水,因此负极的电极反应式为CH3OH-6e-+8OH-= CO32-+6H2O。
Ⅱ.乙中是先电解硫酸铜溶液,后来再电解水的反应,其化学方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() O2↑+2H2↑;乙中有硫酸铜物质的量为0.1mol,A为阳极,生成氧气,B为阴极,先生成铜单质,再生成氢气,A、B产生的气体相等,因此根据电子守恒关系,A产生了xmol氧气,4xmol = 0.1mol×2 + 2xmol,解得x = 0.1mol,V = nVm = 0.1mol×22.4Lmol-1=2.24L。
O2↑+2H2↑;乙中有硫酸铜物质的量为0.1mol,A为阳极,生成氧气,B为阴极,先生成铜单质,再生成氢气,A、B产生的气体相等,因此根据电子守恒关系,A产生了xmol氧气,4xmol = 0.1mol×2 + 2xmol,解得x = 0.1mol,V = nVm = 0.1mol×22.4Lmol-1=2.24L。
Ⅲ.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,阳极为铜,铜失去电子变为铜离子,因此①为铜离子,阴极为铁离子得到电子变为亚铁离子,因此③为铁离子减少,②为亚铁离子增加图像,因此图中②线表示的是Fe2+的变化;根据图像得出铜离子物质的量为0.2mol,亚铁离子物质的量为0.5mol,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,则需要NaOH物质的量为0.2mol×2 + 0.5mol×2 = 1.4mol,则需要5.0 mol·L-1 NaOH溶液![]() 。
。
(1)该反应是放热反应,升高温度,平衡逆向移动,转化率减小,因此Z为270 ℃,故答案为:270 ℃。
(2)Ⅰ.甲中燃料为负极,氧化剂为正极,因此甲醇为负极,在碱性条件下失去电子变为碳酸根和水,因此负极的电极反应式为CH3OH-6e-+8OH-= CO32-+6H2O,故答案为:CH3OH-6e-+8OH-= CO32-+6H2O。
Ⅱ.乙中是先电解硫酸铜溶液,后来再电解水的反应,其化学方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() O2↑+2H2↑;乙中有硫酸铜物质的量为0.1mol,A为阳极,生成氧气,B为阴极,先生成铜单质,再生成氢气,A、B产生的气体相等,因此根据电子守恒关系,A产生了xmol氧气,4xmol = 0.1mol×2 + 2xmol,解得x = 0.1mol,V = nVm = 0.1mol×22.4Lmol-1=2.24L,故答案为:2.24L。
O2↑+2H2↑;乙中有硫酸铜物质的量为0.1mol,A为阳极,生成氧气,B为阴极,先生成铜单质,再生成氢气,A、B产生的气体相等,因此根据电子守恒关系,A产生了xmol氧气,4xmol = 0.1mol×2 + 2xmol,解得x = 0.1mol,V = nVm = 0.1mol×22.4Lmol-1=2.24L,故答案为:2.24L。
Ⅲ.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,阳极为铜,铜失去电子变为铜离子,因此①为铜离子,阴极为铁离子得到电子变为亚铁离子,因此③为铁离子减少,②为亚铁离子增加图像,因此图中②线表示的是Fe2+的变化;根据图像得出铜离子物质的量为0.2mol,亚铁离子物质的量为0.5mol,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,则需要NaOH物质的量为0.2mol×2 + 0.5mol×2 = 1.4mol,则需要5.0 mol·L-1 NaOH溶液![]() ,故答案为:280。
,故答案为:280。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如下表,下列有关叙述不正确的是
,在不同的温度下该反应的平衡常数如下表,下列有关叙述不正确的是
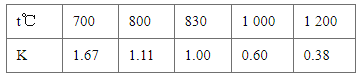
A.该反应的化学方程式是CO(g)+H2O(g)CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol,该反应达到平衡状态
D.若平衡浓度符合关系式![]() =
=![]() ,则此时的温度为1000 ℃
,则此时的温度为1000 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某氨水中加入醋酸溶液,反应方程式如下:NH3·H2O+CH3COOH=CH3COONH4+H2O滴加过程,溶液的导电能力(I)与加入醋酸溶液的体积(V)关系正确的是( )
A. B.
B. C.
C. D.
D.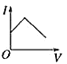
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验过程如图所示:则图③的试管中的现象是
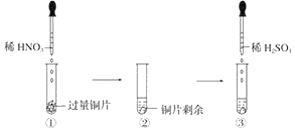
A. 无明显现象,因稀硫酸不与铜反应
B. 铜片溶解,产生无色气体,该气体遇到空气不变色
C. 铜片溶解,放出红棕色有刺激性气味的气体
D. 铜片溶解,产生无色气体,该气体在试管口变为红棕色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下不能实现的是
①S![]() SO3
SO3![]() H2SO4
H2SO4
②N2![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
③MgCl(aq)![]() 无水MgCl2
无水MgCl2![]() Mg
Mg
④Fe![]() Fe2O3
Fe2O3![]() Fe2(SO4)3
Fe2(SO4)3
⑤铝土矿![]() NaAlO2溶液
NaAlO2溶液![]() Al(OH)2
Al(OH)2![]() Al2O2
Al2O2![]() Al
Al
A.①③⑤
B.②③④
C.③④⑤
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
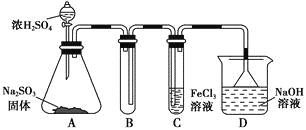
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释,这样操作的目的是________,操作中不需要的仪器有________(填入正确选项前的字母)。
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时,C中观察到的现象为______________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D装置中倒置漏斗的作用是______________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填入正确选项前的字母)。
a.浓H2SO4b.酸性KMnO4溶液
c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置Ⅰ为新型电池,放电时B电极的反应式为NaBr3+2Na++2e-=3NaBr,装置Ⅱ为铅蓄电池。首先闭合K1和K2,当铅蓄电池充电结束后,断开K1,闭合K2。下列说法正确的是

A.装置Ⅰ放电时的A电极反应式为2Na2S2-2e-=Na2S4+2Na+
B.闭合K1、K2时,每有0.1molNa+通过离子交换膜,装置Ⅱ溶液中有0.1mol电子转移
C.断开K1、闭合K2时,b电极的电极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O
D.断开K1、闭合K2时,装置Ⅱ中SO42-向a电极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论错误的有( )
序号 | 规律 | 结论 |
① | 活泼金属的氧化物为碱性氧化物 |
|
② | 酸与酸性氧化物不能发生反应 | 氢氟酸可以储存在玻璃试剂瓶中 |
③ | 较弱酸不能制取较强酸 | 氢硫酸不能制取硫酸 |
④ | 复分解反应均不是氧化还原反应 | 酸碱中和反应中没有电子的转移 |
A.①②③B.②③④C.①③④D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.![]() =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
B.滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Al3+、K+、Cl-、SO42-
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com