
ŌŚŌŖĖŲÖÜĘŚ±ķ¶ĢÖÜĘŚŌŖĖŲÖŠ£¬A”¢B”¢C”¢MŹĒµ„ÖŹ”£MŹĒŅ»ÖÖČÕ³£³£ÓĆ½šŹō£¬ÓŠ¹Ų×Ŗ»ÆČēĶ¼£ŗ

Ēė»Ų“š£ŗ
£Ø1£©ŌŖĖŲMŌŚŌŖĖŲÖÜĘŚ±ķµÄĪ»ÖĆ£ŗ ÖÜĘŚ£¬ Ö÷×唣
£Ø2£©¢ŁŠ“³öBÓėCŌŚ¼ÓČČĢõ¼žĻĀ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ
¢Ś CÓėD·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ
¢ŪŠ“³öMÓėFµÄĖ®ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ
£Ø3£©½«1mol EŗĶ1molĢ¼ĖįĒāÄĘ»ģŗĻ·ÅŌŚĆܱÕČŻĘ÷ÖŠ¼ÓČČ£¬¼ÓČČÖĮ300”ę¾³ä·Ö·“Ó¦ŗóÅųöĘųĢ唣
Š“³ö£ŗ
¢ŁČŻĘ÷ÄŚ²ŠĮōµÄ¹ĢĢåĪļÖŹĆū³Ę¼°ĘäĪļÖŹµÄĮæ £»
¢ŚŌŚČŻĘ÷ÖŠ·¢ÉśµÄ»Æѧ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ £»
£Ø15·Ö£©
£Ø1£©Čż£¬¢óA£Øø÷1·Ö£©
£Ø2£©2Na+O2 Na2O2£Ø2·Ö£© 2Na+2H2O=2NaOH+H2”ü£Ø2·Ö£©
£Ø3£©2Al+2OH”Ŗ+2H2O 2AlO2”Ŗ+3H2”ü£Ø2·Ö£©
£Ø4£©Ģ¼ĖįÄĘ£Ø1·Ö£©£¬1mol£Ø1·Ö£©£¬ĒāŃõ»ÆÄĘ£Ø1·Ö£© 1mol£Ø1·Ö£©
2NaHCO3Na2CO3+H2Oӟ+CO2ӟ 2Na2O2+2CO2
2Na2CO3+O2
2Na2O2+2H2O===4NaOH+O2£ØĆæøö1·Ö£©
½āĪö:Ņ»¶ØŅŖ×¢Ņā±¾ĢāĖłÉę¼°µÄŌŖĖŲ¾łĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬MŹĒŅ»ÖÖČÕ³£³£ÓĆ½šŹō£¬æÉÖŖMĪŖĀĮ”£ĀĮŗĶµ„ÖŹBæÉ·“Ó¦£¬øł¾ŻBµÄ»ÆŗĻĪļ¼°ŠŌÖŹ£¬æɲĀ²āBĪŖŃõĘų£»½ų¶ųæÉÖŖD”¢E·Ö±šŹĒÓÉA”¢CŗĶŃõĘų·“Ó¦µĆµ½£¬¾łĪŖŃõ»ÆĪļĒŅæÉ·“Ó¦²śÉśŃõĘų£¬æÉĶĘ²ā³öD”¢EÓ¦øĆŹĒNa2O2”¢CO2»ņNa2O2”¢H2O£»ŌŁÓÉD”¢EµÄ²śĪļFæÉÓėĀĮ·“Ó¦æÉÖŖD”¢EÓ¦øĆŹĒNa2O2”¢H2O·“Ӧɜ³ÉĮĖF£ŗNaOH”£ÓÉF£ØNaOH£©ÓėM£ØĀĮ£©·“Ӧɜ³ÉĮĖAÓėH£¬æÉÖŖAĪŖĒāĘų”£
µ½“ĖĪŖÖ¹£¬æÉÖŖA”¢B”¢C·Ö±šĪŖĒāĘų”¢ŃõĘų”¢Äʵ„ÖŹ”£
£Ø3£©½«1mol Na2O2ŗĶ1molĢ¼ĖįĒāÄĘ»ģŗĻ·ÅŌŚĆܱÕČŻĘ÷ÖŠ¼ÓČČ£¬·¢ÉśĻĀĮŠ·“Ó¦£ŗ
2NaHCO3Na2CO3+H2Oӟ+CO2ӟ
2Na2O2+2CO2 2Na2CO3+O2
2Na2O2+2H2O===4NaOH+O2£ØĆæøö1·Ö£©
NaHCO3·Ö½ā²śÉśµÄĮ½øöĘųĢåĒ”ŗĆÓėNa2O2·“Ӧɜ³ÉĻąÓ¦µÄ²śĪļ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
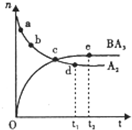 A”¢B”¢C”¢D”¢E”¢FĮłÖÖŌŖĖŲ·ÖŹōČżøö¶ĢÖÜĘŚ£¬ĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬AµÄŌ×ÓŌŚÖÜĘŚ±ķÖŠ°ė ¾¶×īŠ”£¬A”¢DĖÅÖ÷×壬æÉŠĪ³ÉĄė×Ó»ÆŗĻĪļDA£»C”¢FĶ¬Ö÷×壬æÉŠĪ³ÉFC2£¬FC3Į½ÖÖ·Ö×ÓB£¬D£¬E ČżÕßµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĮ½Į½Ö®¼ä¾łæÉ·“Ӧɜ³ÉæÉČÜŠŌŃĪŗĶĖ®£¬ĖłµĆŃĪÖŠ¾łŗ¬CŌŖ ĖŲ£®ĒėĢīŠ“ĻĀĮŠæÕ°×£ŗ
A”¢B”¢C”¢D”¢E”¢FĮłÖÖŌŖĖŲ·ÖŹōČżøö¶ĢÖÜĘŚ£¬ĒŅŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬AµÄŌ×ÓŌŚÖÜĘŚ±ķÖŠ°ė ¾¶×īŠ”£¬A”¢DĖÅÖ÷×壬æÉŠĪ³ÉĄė×Ó»ÆŗĻĪļDA£»C”¢FĶ¬Ö÷×壬æÉŠĪ³ÉFC2£¬FC3Į½ÖÖ·Ö×ÓB£¬D£¬E ČżÕßµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĮ½Į½Ö®¼ä¾łæÉ·“Ӧɜ³ÉæÉČÜŠŌŃĪŗĶĖ®£¬ĖłµĆŃĪÖŠ¾łŗ¬CŌŖ ĖŲ£®ĒėĢīŠ“ĻĀĮŠæÕ°×£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
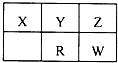 ¶ĢÖÜĘŚŌŖĖŲX”¢Y”¢Z”¢RŗĶWŌŚŌŖĖŲÖÜĘŚ±ķµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬ĘäÖŠWŌŖĖŲ×åŠņŹżµČÓŚÖÜĘŚŠņŹżµÄ2±¶£®ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
¶ĢÖÜĘŚŌŖĖŲX”¢Y”¢Z”¢RŗĶWŌŚŌŖĖŲÖÜĘŚ±ķµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬ĘäÖŠWŌŖĖŲ×åŠņŹżµČÓŚÖÜĘŚŠņŹżµÄ2±¶£®ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A”¢Ō×Ó°ė¾¶“ÓŠ”µ½“ó£ŗX£¼Y£¼R£¼W | B”¢Z”¢WŌŖĖŲÓėX¾łæÉŅŌŠĪ³ÉAB2ŠĶ»ÆŗĻĪļ | C”¢XÓŠ¶ąÖÖĶ¬ĖŲŅģŠĪĢ壬¶ųZ²»“ęŌŚĶ¬ĖŲŅģŠĪĢå | D”¢ZµÄĒā»ÆĪļĪČ¶ØŠŌ“óÓŚWµÄĒā»ÆĪļĪČ¶ØŠŌ£¬ŹĒŅņĪŖZµÄĒā»ÆĪļ·Ö×Ó¼ä“ęŌŚĒā¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĪåÖÖŌŖ¶ĢÖÜĘŚŌŖĖŲÓŠ¹ŲŹż¾ŻČē±ķ”£ĘäÖŠµÄXŹĒ±ķŹ¾ŌŖĖŲŌ×ÓŌŚ·Ö×ÓÄŚĪüŹÕµē×ÓÄÜĮ¦µÄ“󊔣¬XŌ½“ó£¬Ō×ÓĪüŅżµē×ÓµÄÄÜĮ¦Ō½Ē棬Ęä×ī“óÖµĪŖ4.0£¬×īŠ”ÖµŹĒ0.7”£ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
| ŌŖĖŲ±ąŗÅ | A | B | C | D | E |
| X | 3.5 | 3.0 | X3 | 1.5 | 1.5 |
| Ö÷ŅŖ»ÆŗĻ¼Ū | -2 | +7 | +6 | +3 | +2 |
£Ø1£©X3µÄÖµÓ¦øĆĪŖ£Ø £©
A£®3.6 B£®3.1 C£®2.5 D£®1.4
£Ø2£©EŌŖĖŲŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ £¬BŌŖĖŲµ„ÖŹµÄµē×ÓŹ½ĪŖ ”£
£Ø3£©AŌŖĖŲµÄŌ×ÓÖŠÓŠ øöĪ“³É¶Ōµē×Ó”£A”¢B”¢CŌŖĖŲŠĪ³ÉµÄµ„ÖŹÖŠ£¬½į¹¹Ī¢Į£¼ä×÷ÓĆĮ¦×īĒæµÄŹĒ £ØŠ“ĪļÖŹĆū³Ę£©”£
£Ø4£©ÓĆŅ»øö»Æѧ·“Ó¦æÉŅŌÖ¤Ć÷BŗĶC·Ē½šŹōŠŌµÄĒæČõ£¬Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ
ӣ
ÓĆŅ»øö»Æѧ·“Ó¦Ņ²æÉŅŌÖ¤Ć÷DŌŖĖŲŗĶÓėDŌŖĖŲĶ¬ÖÜĘŚĒŅŌ×Ó°ė¾¶×ī“óµÄŌŖĖŲ£Ø·ĒĮć×壩µÄ½šŹōŠŌµÄĒæČõ£¬Š“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ
ӣ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2010-2011ѧğĮÉÄžŹ”øßČżµŚĖÄ“ĪÄ£Äāæ¼ŹŌ£ØĄķ×Ū£©»Æѧ²æ·Ö ĢāŠĶ£ŗĢīæÕĢā
£Ø14·Ö£©X”¢Y”¢Z”¢W”¢QŹĒŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄ¶ĢÖÜĘŚÖ÷×åŌŖĖŲ£¬Ļą¹ŲŠÅĻ¢ČēĻĀ±ķ£ŗ
|
ŌŖ ĖŲ |
Ļą¹ŲŠÅĻ¢ |
|
X |
XŌ×ÓŗĖĶā×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµÄ2±¶ |
|
Y |
YµÄĘųĢ¬Ēā»ÆĪļµÄĖ®ČÜŅŗĻŌČõ¼īŠŌ |
|
Z |
ZŹĒµŲæĒÖŠŗ¬Įæ×ī¶ąµÄ½šŹōŌŖĖŲ |
|
W |
³£ĪĀ³£Ń¹ĻĀ£¬WµÄµ„ÖŹŹĒµ»ĘÉ«¹ĢĢå |
|
Q |
”” |
øł¾ŻÉĻŹöŠÅĻ¢»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ŌŖĖŲQŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆ______________________________£®
(2)YµÄ×ī¼ņµ„ĘųĢ¬Ēā»ÆĪļ¼×µÄĖ®ČÜŅŗæÉÓėH2O2·¢Éś·“Ó¦£¬Ęä²śĪļ²»ĪŪČ¾»·¾³£¬»Æѧ·½³ĢŹ½ĪŖ______________________________________£®£ØÓĆŌŖĖŲ·ūŗűķŹ¾£¬ĻĀĶ¬£©
(3)XŗĶĒāŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļ·Ö×ÓÓŠ6øöŌ×Ó£¬Ęä½į¹¹Ź½ĪŖ £®
(4)ŅŃÖŖ£ŗX(s)+O2(g) =XO2(g) ”÷H = -393.5£ėJ”¤mol-1
2X(s)+O2(g) =2XO(g) ”÷H = -221.0£ėJ”¤mol-1
ŌņXOµÄČ¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½__________________________________________________.
(5)ŌŖĖŲYÓėĒāŌŖĖŲŠĪ³ÉµÄĪåŗĖŃōĄė×ÓŅŅ£¬Ļņŗ¬ŅŅŗĶZµÄŃōĄė×ӵĻģŗĻČÜŅŗÖŠ¼ÓČė¹ĢĢåNa2O2£¬ ¼ÓČėNa2O2µÄĪļÖŹµÄĮæÓė²śÉś³ĮµķÓŠČēĶ¼ĖłŹ¾¹ŲĻµ£ŗ

Š“³öÓŠ¹Ų·“Ó¦Ąė×Ó·½³ĢŹ½£ŗ(Ćæ¶ĪÖ»ÓĆŅ»øöĄė×Ó·½³ĢŹ½±ķŹ¾)
o”Ŗa¶Ī
a”Ŗb¶Ī £®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com