
【题目】某学生探究0.25mol/LAl2(SO4)3溶液与0.5mol/LNa2CO3溶液的反应,实验如下。
实验1 |
|
实验2 |
|
下列分析正确的是( )
A. 实验1中,白色沉淀a是Al2(CO3)3
B. 实验2中,白色沉淀b一定是Al2(OH)2(CO3)2
C. 检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液
D. 实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
【答案】C
【解析】
由现象可知:实验1发生完全双水解反应生成Al(OH)3,实验2过量的Na2CO3与完全双水解反应生成Al(OH)3发生反应。
A. 实验1中,沉淀溶解,无气泡,白色沉淀a是Al(OH)3,故A错误;
B. 实验2中,沉淀溶解,少量气泡,该气体是CO2,但不能说明白色沉淀b一定是Al2(OH)2(CO3)2,故B错误;
C. 检验白色沉淀a、b是否洗涤干净,即可检验有无SO42-,均可用盐酸酸化的BaCl2溶液检验,故C正确;
D. 实验1、2中,过量Al2(SO4)3溶液显酸性,过量Na2CO3溶液显碱性,不能确定白色沉淀成分不同的原因与混合后溶液的pH有关,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】在如图所示的三个烧杯中均盛有足量的氯化铜溶液。请按要求回答下列问题:
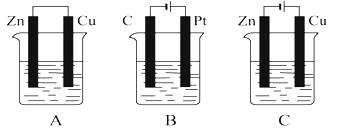
(1)![]() 、
、![]() 、
、![]() 三个装置中不属于电解池的是______。
三个装置中不属于电解池的是______。
(2)![]() 池中
池中![]() 是______极,
是______极,![]() 池中
池中![]() 移向______极(填“
移向______极(填“![]() ”或“
”或“![]() ”)。
”)。
(3)![]() 池中
池中![]() 电极上发生反应__________(填“氧化”或“还原”)
电极上发生反应__________(填“氧化”或“还原”)
(4)![]() 池中
池中![]() 电极上的电极反应为______,反应过程中
电极上的电极反应为______,反应过程中![]() ______(填“变大”“变小”或“不变”)
______(填“变大”“变小”或“不变”)
(5)![]() 池中总反应的化学方程式为______
池中总反应的化学方程式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学原理与应用有非常重要的意义。
(1)锌锰电池(俗称干电池) 是一种一次电池,生活中应用广泛。
①锌锰电池负极上的电极反应式为:______________________________。
②与普通(酸性)锌锰电池相比较,碱性锌锰电池的优点是____________________(回答一条即可)。
(2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
①充电时阴极反应为:________________________________________。
②用铅蓄电池为电源进行电解饱和食盐水实验(石墨棒为阳极,铁为阴极,食盐水500mL,温度为常温),当电路中有0.05mol电子转移时,食盐水的PH为______(假设溶液体积不变,产物无损耗)。
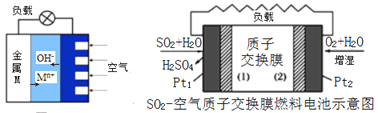
(3)如图是金属(M)-空气电池的工作原理,我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池反应为:___________________________ 。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。Pt2上的电极反应式为:_______________________________________ 。
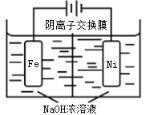
(4)高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,可以用电解法制取:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。电解一段时间后,c(OH)降低的区域在_____________(填“阴极室”或“阳极室”);阳极反应为:___________________________。
FeO42+3H2↑,工作原理如图所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。电解一段时间后,c(OH)降低的区域在_____________(填“阴极室”或“阳极室”);阳极反应为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:

请回答下列问题:
(1)A的化学名称为______;C中官能团的名称是_______。
(2)③的反应试剂和反应条件分别是_______,该反应类型是________。
(3)已知吡啶是一种有机碱,在反应⑤中的作用是________
(4)反应④的化学方程式为__________
(5)G的相对分子质量为__________。
(6)![]() 是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
①![]() 直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
(7)参照上述合成路线,以CH3CH2COCl和![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]() 的路线为(其他无机试剂任选)_____。
的路线为(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水凝胶材料要求具有较高的含水率,以提高其透氧性能,在生物医学上有广泛应用。由N-乙烯基吡咯烷酮(NVP)和甲基丙烯酸![]() -羟乙酯(HEMA)合成水凝胶材料高聚物A的路线如图:
-羟乙酯(HEMA)合成水凝胶材料高聚物A的路线如图:
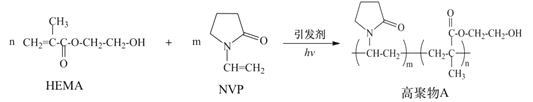
下列说法正确的是
A. NVP具有顺反异构
B. 高聚物A因含有-OH而具有良好的亲水性
C. HEMA和NVP通过缩聚反应生成高聚物A
D. 制备过程中引发剂浓度对含水率影响关系如图,聚合过程中引发剂的浓度越高越好

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。铜绿在一定程度上可以提升青铜器的艺术价值。参与形成铜绿的物质有Cu和_______。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
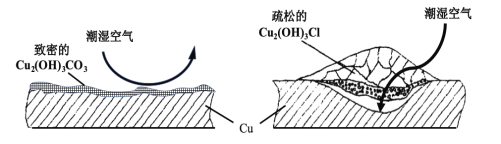
Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因_____________。
(3)文献显示有害锈的形成过程中会产生CuCl(白色不溶于水的固体),请结合下图回答:
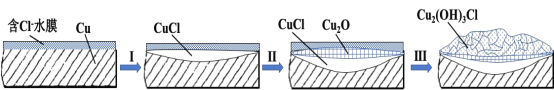
① 过程Ⅰ的正极反应物是___________。
② 过程Ⅰ负极的电极反应式是_____________。
(4)青铜器的修复有以下三种方法:
ⅰ.柠檬酸浸法:将腐蚀文物直接放在2%-3%的柠檬酸溶液中浸泡除锈;
ⅱ.碳酸钠法:将腐蚀文物置于含Na2CO3的缓冲溶液中浸泡,使CuCl转化为难溶的Cu2(OH)2CO3;
ⅲ.BTA保护法:
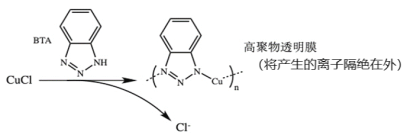
请回答下列问题:
①写出碳酸钠法的离子方程式___________________。
②三种方法中,BTA保护法应用最为普遍,分析其可能的优点有___________。
A.在青铜器表面形成一层致密的透明保护膜
B.替换出锈层中的Cl-,能够高效的除去有害锈
C.和酸浸法相比,不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
A.用A表示的化学反应速率是0.4mol·L-1·min-1
B.分别用B、C、D表示化学反应速率,其比是3∶2∶1
C.在2min末的反应速率用B表示是0.3mol·L-1·min-1
D.在这2min内B和C两物质的浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国内某科技研究小组首次提出一种新型的Li+电池体系,该体系征集采用含有I-、Li+的水溶液,负极采用固体有机聚合物,电解质溶液采用LiNO3溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知:I-+I2=I3-,则下列有关判断正确的是

A. 图甲是原电池工作原理图,图乙是电池充电原理图
B. 放电时,正极液态电解质溶液的颜色变浅
C. 充电时,Li+从右向左通过聚合物离子交换膜
D. 放电时,负极的电极反应式为:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)写出下列元素的元素符号:①___,②___;
(2)在这些元素中,最活泼的金属元素是___,最不活泼的元素是___。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是___,碱性最强的是___,呈两性的氢氧化物是___。
(4)写出③和⑧的单质反应产物的电子式___。
(5)![]() C在周期表中的位置:第___周期___族,它与氧气完全燃烧的产物的电子式___。
C在周期表中的位置:第___周期___族,它与氧气完全燃烧的产物的电子式___。
(6)在③与④的单质中,化学性质较活泼的是___,判断的实验依据是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com