
【题目】下列物质发生化学反应,其化学反应类型属于加成反应又叫还原反应的是( )
A. 氢气和苯 B. 乙炔和氯化氢 C. 乙醇和浓硫酸 D. 甲烷和氯气
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
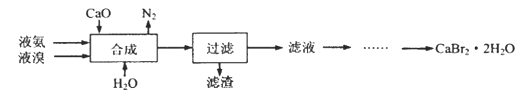
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。
(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出9种元素在周期表中的位置,请按要求回答问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)⑦的简单离子的结构示意图是______。表中标注的元素的最高价氧化物对应的水化物中碱性最强的碱是_____(填写化学式)。③、④、⑨三种元素按原子半径由大到小的顺序排列为 ______ (用元素符号表示)。
(2)元素②的气态氢化物的电子式是_______。由3个元素②的原子组成带一个单位负电荷的阴离子中含有_______个电子。写出该元素氢化物与其最高价氧化对应水化物反应的离子方程
式_____________。
(3)⑦、⑧两元素简单离子还原性强弱为______(填离子符号)。
(4)某研究性学习小组设计了一组实验验证元周期律。
Ⅰ:甲同学在A、B两只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的③、⑨元素单质,观察现象。甲同学设计实验的目的是_____。写出元素⑨的单质与水反应的化学方程式为________。
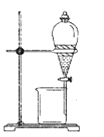
Ⅱ:乙同学设计如图装置以验证①、⑥、⑦元素的非金属性强弱。为了达到实验目的,仪器A、B、C分别选择的药品为A______、B______、C______;烧杯中发生反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质。
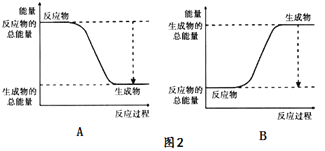
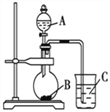
(1)按如图装置进行实验,可观察到反应剧烈,火星四射,漏斗下方有红热熔融物“铁块”流出。
该反应的化学方程式为_____,其能量变化为如图中的______(填“A”或“B”)所示。
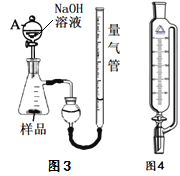
(2)某校化学兴趣小组同学,为了测定铝热反应后得到“铁块”混合物中铝的含量。取“铁块”样品研碎称得质量为x g,加入如图装置,再滴入足量NaOH溶液充分反应,测量生成气体体积为a ml(标况)。
①仪器A的名称为_______。
②写出样品中Al与NaOH反应的化学方程式_______。
③该小组同学改进实验,用恒压漏斗(如图)代替仪器A,其优点有________(写2点)。
④该样品中铝的含量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是

A.该装置能量转化形式是电能转化为化学能
B.负极反应式为:CH2=CH2-2e-+H2O=CH3CHO +2H+
C.每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol
D.电子移动方向:电极a→磷酸溶液→电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O 的一种工艺流程如下:

已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2 =MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用
a.盐酸 b.硫酸 c.硝酸
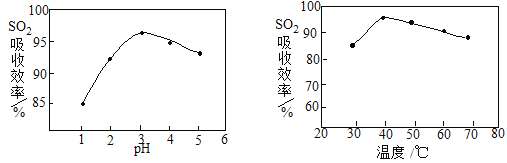
(2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是 。
(3) 流程中“氧化”步骤主要反应的离子方程式是 。
(4) 加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是 。
(5) 用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:
① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③ I2+2S2O32-=S4O62-+2I-。
计算水样中溶解氧的浓度(以mg·L-1为单位),写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度能加快化学反应速率的主要原因是( )
A. 增加活化分子百分数 B. 降低活化分子的能量
C. 活化分子能量明显增加 D. 降低反应所需的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是

A.MOH是一种弱碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)=10 c(MOH)
D.稀释前MOH溶液和ROH溶液中由水电离出的c(OH﹣)后者是前者的 10倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com