
| A. | 升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 | |
| B. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| C. | 对于有气体参加的反应,增大压强,反应速度加快 | |
| D. | 恒容容器中,在气体反应体系中充入稀有气体,化学反应速率不发生改变 |
分析 A.升高温度能使所有的化学反应速率加快,与反应热无关;
B.决定化学反应速率是物质本身的性质;
C.对应有气体参加的化学反应,增大压强,物质浓度增大,反应速率加快;
D.恒容容器中,在气体反应体系中充入稀有气体,反应物和生成物浓度不变,则化学反应速率不发生改变.
解答 解:A.升高温度能增大活化分子百分数,所以能使所有的化学反应速率加快,与反应热无关,故A错误;
B.决定化学反应速率是物质本身的性质,外界只是影响因素,故B正确;
C.对应有气体参加的化学反应,增大压强,体积减小,物质浓度增大,单位体积内活化分子个数增大多,所以反应速率加快,故C正确;
D.恒容容器中,在气体反应体系中充入稀有气体,反应物和生成物物质的量不变、容器体积不变导致反应物和生成物浓度不变,则化学反应速率不发生改变,故D正确;
故选A.
点评 本题考查化学反应速率影响因素,为高频考点,温度、浓度、压强、催化剂、反应物接触面积等都是影响因素,本身的性质决定其反应速率,易错选项是A,注意:温度对化学反应速率的影响与反应热无关.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.01mol•L-1的NH4Cl和0.01mol•L-1的NH3•H2O等体积混合后,若测得溶液中c (Cl-)>c (NH4+),则溶液中有关微粒的浓度关系: c (Cl-)>c (NH3•H2O)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 0.1mol的NaHS和0.1mol的NaHSO4混合溶于水,配制成1L溶液,则混合溶液中离子浓度关系为:c (Na+)-0.1mol•L-1=2c (S2-)+c (H2S)+c (HS-) | |
| D. | 0.1mol•L-1的NaHCO3溶液中离子浓度关系:c (OH-)=c (H+)+c (H2CO3)-c (CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸银溶液,有白色沉淀生成,证明一定有Cl-存在 | |
| B. | 加入BaCl2溶液和稀硝酸,有白色沉淀生成,证明一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
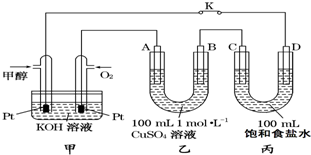 如图是甲醇(CH3OH)燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
如图是甲醇(CH3OH)燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol HClO溶于水电离出NA个H+ | |
| B. | 标准状况下,11.2L的CCl4中含有0.5 NA个分子 | |
| C. | 足量Fe与1 mol Cl2充分反应,转移电子数为2NA | |
| D. | 18.0 g重水(D2O)中所含的电子数为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| B. | 1mol甲烷最多与2molCl2发生取代反应 | |
| C. | 标准状况下,2.24L乙醇含有的分子数目为0.1NA | |
| D. | 0.5 mol苯分子中含有C=C双键数为1.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com