
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液:c(NH4+)大小顺序为①>②>③ | |
| B. | 0.2mol•L-1CH3COOH溶液和0.2mol•L-1CH3COONa溶液等体积混合:c(CH3COOH)+c(CH3COO-)=2c(Na+) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 0.1mol•L-1NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4g | B. | 6.8g | C. | 10.2g | D. | 27.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
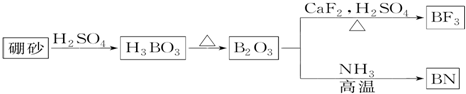
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有主族元素的最高正化合价都等于其最外层电子数 | |
| B. | 所有过渡元素都是金属元素,所有的金属元素也都是过渡元素 | |
| C. | 在周期表中氧族元素的单质全部是气体 | |
| D. | 同周期主族元素的原子半径以ⅦA族的为最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素A、B、C、D分别为O、Ca、Na、Ar | |
| B. | 元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 | |
| C. | 元素A、C简单离子的半径大小关系为A<C | |
| D. | 元素B、C的单质与水都能剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)明矾可用于净水,用离子方程式解释其原因Al3++3H2O?Al(OH)3(胶体)+3H+.把FeCl3溶液蒸干、灼烧、最后得到的主要固体产物是Fe2O3.
(1)明矾可用于净水,用离子方程式解释其原因Al3++3H2O?Al(OH)3(胶体)+3H+.把FeCl3溶液蒸干、灼烧、最后得到的主要固体产物是Fe2O3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com