
| A.萃取分液; | B.加热分解; | C.蒸发结晶; | D.分液;E、蒸馏;F、过滤等,请将提纯或分离方法的序号填在后面横线上。 |
科目:高中化学 来源:不详 题型:单选题
| A.②⑤④①③ | B.④①②⑤③ |
| C.④②⑤①③ | D.①④②⑤③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④⑤ | B.②⑤①③④ | C.①③⑤②④ | D.②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


| | 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
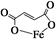 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。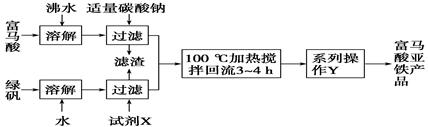
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
| ② | |
| ③ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
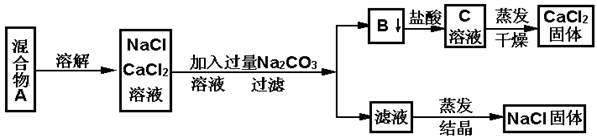
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去Fe(OH)3胶体中的FeCl3 | 过滤 | 分散质微粒的大小不同 |
| B | 除去纯碱中的碳酸氢铵 | 加热 | 稳定性不同 |
| C | 分离KNO3和NaCl | 重结晶 | KNO3的溶解度大于NaCl |
| D | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
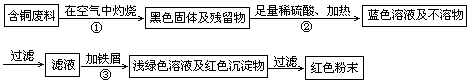
 2CuSO4+2H2O ) ,于是他提出了另一套方案:
2CuSO4+2H2O ) ,于是他提出了另一套方案: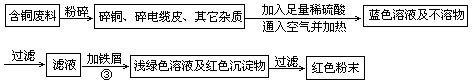
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com