
��14�֣���ҵ��һ���ں����ܱ������п��Բ������з�Ӧ�ϳɼ״���CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
��1���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ�__________
| A������CH3OH������������CO��������� | B�����������ܶȲ��� |
| C�������������ƽ�������������� | D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯 |
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
��C�� D���Ƣ�K=c(CH3OH)/c(CO)��c2(H2) �� �ڡ�H��0����250��
�� CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ��H=��725.76 kJ / mol
�� ����CH3OH -6e��+8OH��=CO32��+6H2O �� ������״���µ�O216.8��
�������������A. CH3OH���������CO�Ƿ�Ӧ����κ�ʱ�̶���������CH3OH������������CO��������ȣ���˲�����Ϊ�ж�ƽ��ı�־������B. ���ڷ�Ӧ��������̶����ܱ������н��У���Ӧǰ����ѭ�����غ㶨�ɣ����������۷�Ӧ�Ƿ�ﵽƽ�⣬���������ܶȶ����䡣��˲�����Ϊ�ж�ƽ��ı�־������C. ���ڸ÷�Ӧ�Ǹ���Ӧǰ������������ȵĿ��淴Ӧ����δ�ﵽƽ�⣬��������ʵ�����Ҫ�����仯����������ܶ�ҲҪ�����仯���������������ƽ����������ҲҪ�����仯����˻����������ƽ�������������䡣������Ϊ�жϷ�Ӧ�ﵽƽ��ı�־����ȷ��D. ����Ӧ�ﵽƽ�⣬��Ӧ�������CH3OH��CO��H2���κ�һ����ֵ�����Ũ�������Ũ����ȣ���Ũ�ȶ����ٷ����仯����˿�����Ϊ�жϷ�Ӧ�ﵽƽ��ı�־����ȷ���� �ٻ�ѧƽ�ⳣ���ǿ��ܷ�Ӧ�ﵽƽ��״̬ʱ��������Ũ����ָ���ij˻������Ӧ��Ũ����ָ���ij˻��ıȡ�����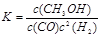 �����ɱ������ݿ�֪�������¶ȣ���ѧƽ�ⳣ����С��˵�������¶ȣ���ѧƽ�������ƶ�������ƽ���ƶ�ԭ���������¶Ȼ�ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ�������Ը÷�Ӧ������ӦΪ���ȷ�Ӧ����H��0����CO(g)+2H2(g)
�����ɱ������ݿ�֪�������¶ȣ���ѧƽ�ⳣ����С��˵�������¶ȣ���ѧƽ�������ƶ�������ƽ���ƶ�ԭ���������¶Ȼ�ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ�������Ը÷�Ӧ������ӦΪ���ȷ�Ӧ����H��0����CO(g)+2H2(g) CH3OH(g)�ڷ�Ӧ��ʼʱc(CO)=1mol/L��c(H2)=3mol/L��c(CH3OH)=0mol/L������Ӧ�ﵽƽ��ʱ��C(CO)=0.2mol/L,���Ը��ݷ���ʽ�и������ʵĹ�ϵ��֪c(H2)=1.4mol/L��c(CH3OH)= 0.8mol/L��ѧƽ�ⳣ��
CH3OH(g)�ڷ�Ӧ��ʼʱc(CO)=1mol/L��c(H2)=3mol/L��c(CH3OH)=0mol/L������Ӧ�ﵽƽ��ʱ��C(CO)=0.2mol/L,���Ը��ݷ���ʽ�и������ʵĹ�ϵ��֪c(H2)=1.4mol/L��c(CH3OH)= 0.8mol/L��ѧƽ�ⳣ��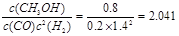 ���Է�Ӧ�¶�Ϊ250�档��3��ȼ������1mol��������ȫȼ�ղ����ȶ���������ʱ�ų���������������Ŀ�ṩ�����ݿ�֪����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ��H=��725.76 kJ / mol����4����ȼ�ϵ���У�ͨ��ȼ�ϵĵ缫Ϊ������ͨ�������ĵ缫Ϊ���������ڵ����Ϊ���ԣ������ڸ����ĵ缫��ӦʽΪCH3OH -6e��+8OH��=CO32��+6H2O��n(CH3OH)=16g��32g/mol=0.5mol.����n(e-)=0.5mol��6=3mol.���ݵ����غ�ɵ�n(O2)=3mol��4=0.75mol,V(O2)= 0.75mol��22.4L/mol=16.8L��
���Է�Ӧ�¶�Ϊ250�档��3��ȼ������1mol��������ȫȼ�ղ����ȶ���������ʱ�ų���������������Ŀ�ṩ�����ݿ�֪����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ��H=��725.76 kJ / mol����4����ȼ�ϵ���У�ͨ��ȼ�ϵĵ缫Ϊ������ͨ�������ĵ缫Ϊ���������ڵ����Ϊ���ԣ������ڸ����ĵ缫��ӦʽΪCH3OH -6e��+8OH��=CO32��+6H2O��n(CH3OH)=16g��32g/mol=0.5mol.����n(e-)=0.5mol��6=3mol.���ݵ����غ�ɵ�n(O2)=3mol��4=0.75mol,V(O2)= 0.75mol��22.4L/mol=16.8L��
���㣺���黯ѧƽ��״̬���жϡ���ѧƽ�ⳣ���ı��P���㡢ȼ�ϵ�صĵ缫ʽ������Ӧ�ļ����֪ʶ��


 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д� ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
̼�����ڹ�ҵ���ж�����;�����罹̿��������ȡˮú����ұ������������̿�ɴ���������Ⱦ��NO��
һ�������£���2 L�ܱ������м���NO�ͻ���̿�������ʣ���Ӧ��������A��B�����¶���T1��ʱ����ø�����ƽ��ʱ���ʵ������±���
| | ����̿ (mol) | NO (mol) | A (mol) | B (mol) |
| ��ʼ | 2.030 | 0.100 | 0 | 0 |
| ƽ�� | 2.000 | 0.040 | 0.030 | 0.030 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
T��ʱ��A��B��C���������ڷ�Ӧ�����е�Ũ�ȱ仯��ͼ1��ʾ�������������������䣬�¶ȷֱ�ΪT1���T2��ʱ��B��Ũ�ȱ仯��ʱ��Ĺ�ϵʾ��ͼ��ͼ2��ʾ��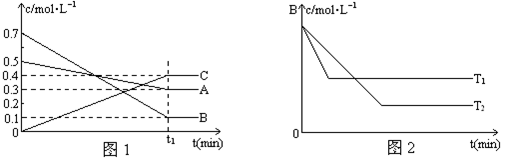
��ش��������⣺
��1���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ�ǣ�
��2���Ƚϴ�С��
A��B��ת����A B��ԭ����
�¶ȵĸߵ�T1 T2���ж�������
��3���������������䣬��Ӧ���е���t1+10��minʱ��A��Ũ��Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
(14��)��ҵ������·ѭ����������������Ĺ�����������ͼ��ʾ��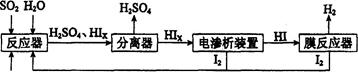
�ش��������⣺
��1���ڷ�Ӧ���з�����Ӧ�Ļ�ѧ����ʽ��______________��
��2����Ĥ��Ӧ���з�����Ӧ��2HI(g) H2(g)ʮI2 ��H>0������һ���������ܱ������м���l mol HI(g)�� n(H2)��ʱ��(t)�ı仯��ͼ��ʾ��
H2(g)ʮI2 ��H>0������һ���������ܱ������м���l mol HI(g)�� n(H2)��ʱ��(t)�ı仯��ͼ��ʾ��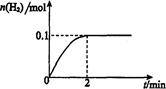
�ٸ��¶��£���Ӧƽ�ⳣ��K=_______���������¶ȣ�Kֵ��_______
(���������������?��)��
���û�ѧƽ��ԭ������ʹ��Ĥ��Ӧ����ʱ�����H2��Ŀ����___________________
��3��������װ������ͼ��ʾ��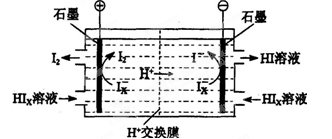
�ٽ�ϵ缫��Ӧʽ����������HIxת��ΪHI��ԭ����______________________________
�ڸ�װ���з������ܷ�Ӧ�Ļ�ѧ����ʽ��________________________
��4����������������ѭ�����õ�������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��16�֣�I����CH4����ԭ��������������������������Ⱦ����֪��
��CH4��g��+4NO2��g��=4NO��g��+ CO2��g��+2H2O��g�� ��H=" -574" kJ��mol-l
��CH4��g��+4NO��g��=2N2��g��+ CO2��g��+ 2H2O��g�� ��H=" -1160" kJ��mol-l
��H2O��g��=H2O��1�� ��H=-44��0 kJ��mol-l
д��CH4��g����NO2��g����Ӧ����N2��g����CO2��g����H2O��1�����Ȼ�ѧ����ʽ____ ��
II����������Դ�����ϴ������ǿɳ�����չ����Ҫ���档
��1����̼��������Ӯ�Ӻϳ��Ҵ�ȼ���ѽ�����ģ���������ȡ��CO��H2Ϊԭ�Ϻϳ��Ҵ�����ѧ��Ӧ����ʽ��2CO��g��+4H2��g����CH3CH2OH��g��+H2O��g��;���ܱ������г���10 mol CO��20mol H2���ڴ��������·�Ӧ�����Ҵ���CO��ת���ʣ�a�����¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
����A��B�����ʾ��ijʱ�̴ﵽ��ƽ��״̬����ʱ��A��ʱ���������Ϊ10L������¶��µ�ƽ�ⳣ����K=____ ��
����A��C���㶼��ʾ�ﵽ��ƽ��״̬�����Ӧ��ʼ����ƽ��״̬�����ʱ��tA tC���� ��>������<����=������
��2����ǰ��ҵ��Ҳ������CO2�������״���һ�������·�����Ӧ��CO2��g��+3H2��g��  CH3OH��g��+H2O��g����H<0������6mo1 CO2��8mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���
CH3OH��g��+H2O��g����H<0������6mo1 CO2��8mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���
�����ı�ijһʵ�������ٽ�������ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı������ ������II��Ӧ��ʵ�������ı������____ ��
�����ڴ����ͼ�л���״������ʵ�����ʱ��仯���ߡ�
III����MnO2��KMnO4�Ĺ���������ͼ���������������Ͼ�Ϊ̼������ˮ��������Һ��K2MnO4�����绯�����MnO2��KMnO4��
��д��240������ʱ������Ӧ�Ļ�ѧ����ʽ ��Ͷ��ʱ��������n��KOH��:n��MnO2�� ��
�������ĵ缫��ӦΪ ��
��B������ ���ѧʽ��������ѭ��ʹ�õ������� ���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��15�֣�ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
��ʵ��ԭ����2KMnO4 + 5H2C2O4 + 3H2SO4�� K2SO4 + 2MnSO4 + 10CO2�� + 8H2O
��ʵ�����ݼ���¼��
| ʵ���� | �����£��Թ��������Լ��������� / mL | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05mol/L KMnO4��Һ | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |

| ʵ���� | �����£��Թ��������Լ��������� / mL | �����Թ��м����������� | ��������Һ��ɫ������ɫ����ʱ�� / min | |||
| 0.6 mol/L H2C2O4��Һ | H2O | 3 mol/L ϡ���� | 0.05 mol/L KMnO4��Һ | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��1���֣�
Cl2��һ����Ҫ�Ļ���ԭ�ϡ�
��1����ⱥ��NaCl��Һ���Cl2�Ļ�ѧ����ʽ��_______��
��2��Ϊ���ڴ��棬Ҫ������Һ��[ Cl2(g)  Cl2(l) ]��Ӧ��ȡ�Ĵ�ʩ��_______��д��һ�����ɣ���
Cl2(l) ]��Ӧ��ȡ�Ĵ�ʩ��_______��д��һ�����ɣ���
��3��Һ�ȴ��������е�˵�������£����֣���
| ���� |  |
| ����Ҫ�� | Զ�������ĩ���������ࡢ�������ʣ�������������� |
| й©���� | NaOH��NaHSO3��Һ���� |
| ��װ | ��ƿ |
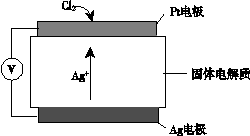

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��Ļ������������Ϳ����з�������Ҫ���á�
��1��SO2Cl2����������ҽҩƷ��Ⱦ�ϡ�������Լ��ȡ���֪��SO2Cl2(g) SO2(g)��Cl2(g) ��H����97.3 kJ��mol��1��ij�¶�ʱ�����Ϊ1 L�ĺ����ܱ������г���0. 20mol SO2Cl2���ﵽƽ��ʱ�������к�0.18mol SO2����˹��̷�Ӧ���յ�����Ϊ_____ kJ�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ_____�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ_______��
SO2(g)��Cl2(g) ��H����97.3 kJ��mol��1��ij�¶�ʱ�����Ϊ1 L�ĺ����ܱ������г���0. 20mol SO2Cl2���ﵽƽ��ʱ�������к�0.18mol SO2����˹��̷�Ӧ���յ�����Ϊ_____ kJ�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ_____�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ_______��
��2����ҵ���Ʊ�����Ĺ����д��ڷ�Ӧ��2SO2(g)��O2(g) 2SO3(g) ��H����198kJ��mol��1��400�棬1.01��105Pa�����ݻ�Ϊ2L�ĺ����ܱ������г���һ���� SO2��O2��n(SO3)��n(O2)��ʱ��ı仯������ͼ��ʾ��
2SO3(g) ��H����198kJ��mol��1��400�棬1.01��105Pa�����ݻ�Ϊ2L�ĺ����ܱ������г���һ���� SO2��O2��n(SO3)��n(O2)��ʱ��ı仯������ͼ��ʾ��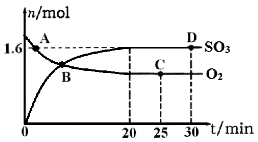
��0��20min��Ӧ��ƽ�����ʦ�(O2)��___________��
������������ȷ���� ��
a��A�����(SO2)������(SO2)
b��B�㴦��ƽ��״̬
c��C���D��n(SO2)��ͬ
d�������������䣬500��ʱ��Ӧ��ƽ�⣬n(SO3)��ͼ��D���ֵ��
��3����ҵ����Na2SO3��Һ���������е�SO2��������ͨ��1.0 mol��L��1��Na2SO3��Һ������ҺpHԼΪ6ʱ��Na2SO3��Һ����SO2�����������½���Ӧ�������ռ�����ʱ��Һ��c (SO32��)��Ũ����0.2 mol��L��1������Һ��c(HSO3��)��__mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�̶�������CO2������Ч��������Դ�������ٿ����е��������塣��ҵ�������о�����CO2�������״�ȼ�ϵķ������÷����Ļ�ѧ����ʽ�ǣ�
CO2��g����3H2��g�� CH3OH��g����H2O��g��
CH3OH��g����H2O��g��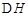 =-49��0kJ��mol
=-49��0kJ��mol
ij��ѧʵ��С�齫6mol CO2��8mol H2����һ�ݻ�Ϊ2L���ܱ������У��¶ȱ��ֲ��䣩�����H2�����ʵ�����ʱ��仯����ͼ��ʵ����ʾ��ͼ����ĸ������ֱ�ʾ��Ӧ�����꣩���ش��������⣺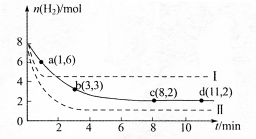
��1���÷�Ӧ��0~8min��CO2��ƽ����Ӧ������ mol��L-1��min-1
��2�����¶��¸÷�Ӧ��ƽ�ⳣ��K����ֵΪ ��
��3�����ı�ijһ�����ٽ���ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ��
��ʵ����ȣ����ߢ�ı������������ �����ߢ�ı������������ ����ʵ�߶�Ӧ������ƽ�ⳣ��Ϊ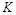 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ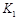 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ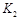 ����
����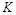 ��
��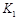 ��
��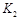 �Ĵ�С��ϵ�� ��
�Ĵ�С��ϵ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com