
| A. | 加热后在空气中冷却称量固体 | B. | 晶体中含有加热易挥发的杂质 | ||
| C. | 实验所取晶体已有部分脱水 | D. | 晶体加热时脱水不完全 |
分析 A、加热后在空气中冷却称量固体则会将空气中的水蒸气吸收过来,导致质量差偏小;
B、被测样品中含有加热易挥发的杂质会导致导致质量差偏大;
C、实验前被测样品已有部分失水会导致导致质量差偏小;
D、晶体加热脱水不完全导致质量差偏小.
解答 解:A、加热后在空气中冷却称量固体则会将空气中的水蒸气吸收过来,导致质量差偏小,则测定的水的质量偏小,故A错误;
B、被测样品中含有加热易挥发的杂质会导致质量差偏大,则测定的水的质量偏大,故B正确;
C、实验前被测样品已有部分失水会导致导致质量差偏小,则测定的水的质量偏小,故C错误;
D、晶体加热脱水不完全,会导致质量差偏小,则测定的水的质量偏小,故D错误;
故选B.
点评 本题考查化学实验方案的评价,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型,难度不大,注意把握实验原理和操作的注意事项.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:解答题
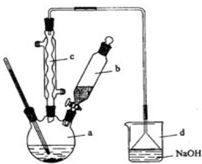 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如表:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 一些物质的溶解性 | ||||
| OH- | Cl- | SO42- | CO32- | |
| H+ | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 | 不 |
| Ba2+ | 溶 | 溶 | 不 | 不 |
| Mg2+ | 不 | 溶 | 溶 | 微 |
| 杂质 | 加入的试剂 |
| CaCl2 | ⅠNa2CO3 |
| MgCl2 | ⅡNaOH |
| 硫酸盐 | ⅢBaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
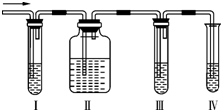 化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图所示的实验装置以确认上述混合气体中有C2H4和SO2.回答下列问题:
化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了如图所示的实验装置以确认上述混合气体中有C2H4和SO2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在所有元素中,氟的第一电离能最大 | |
| B. | 氨气的水溶性大于甲烷的水溶性,原因是氨气分子之间能形成氢键 | |
| C. | 元素的金属性越强,其电负性一定越小 | |
| D. | 根据金属元素的逐级电离能数据可大致推断出此元素的最高化合价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com