
【题目】铁及其化合物之间的相互转化可用下式表示:Fe2+![]() Fe3+
Fe3+![]() Fe
Fe![]() (高铁酸根离子),回答下列问题:
(高铁酸根离子),回答下列问题:
(1)Fe2O3中铁元素化合价为___,实现④的转化需加入___(填“氧化剂”或“还原剂”)。
(2)配平下面的缺项方程式:__FeCl3+__Cl2+____=__Na2FeO4+_____ NaCl+__H2O
(3)已知下列反应可以发生:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O;2Fe3++![]() +H2O=2Fe2++
+H2O=2Fe2++![]() +2H+;Cl2+2Fe2+=2Cl-+2Fe3+。
+2H+;Cl2+2Fe2+=2Cl-+2Fe3+。
由上述反应可知氧化性:Co2O3____(填“>”或“<”)Fe3+。
下列离子方程式错误的是____(填字母)。
a.Co2O3+6H++2Fe2+=2Co2++2Fe3++3H2O
b.![]() +2Cl-+2H+=Cl2↑+
+2Cl-+2H+=Cl2↑+![]() +H2O
+H2O
c.Cl2+![]() +H2O=2Cl-+
+H2O=2Cl-+![]() +2H+
+2H+
【答案】+3 还原剂 2 3 16NaOH 2 12 8 )> b
【解析】
(1)Fe2O3中O元素为-2价,根据化合物中化合价代数和未0可知:铁元素化合价为+3,④Fe元素的化合价降低,被还原,应加还原剂,故答案为:+3;还原剂;
(2)Fe元素化合价从+3升高到+6,升高了3,Cl元素化合价从0降低到-1,降低了2×1=2,根据化合价升高总数=化合价降低总数可知:FeCl3、Na2FeO4前面配2,Cl2前面配3,结合Cl原子守恒可知,NaCl前面配12,根据Na原子守恒、H原子守恒、O原子守恒可知缺项为16NaOH,H2O前面配8,所以该反应的化学方程式为:2FeCl3+3Cl2+16NaOH=2Na2FeO4+12NaCl+8H2O,故答案为:2;3;16NaOH;2;12;8;
(3)氧化剂的氧化性强于氧化产物,结合Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O可知,Co2O3的氧化性强于Cl2,结合Cl2+2Fe2+=2Cl-+2Fe3+可知,Cl2的氧化性强于Fe3+,结合2Fe3++![]() +H2O=2Fe2++
+H2O=2Fe2++![]() +2H+可知,Fe3+的氧化性强于
+2H+可知,Fe3+的氧化性强于![]() ,所以氧化性:Co2O3>Cl2>Fe3+>
,所以氧化性:Co2O3>Cl2>Fe3+>![]() :
:
a.根据化学方程式分析出:Co2O3的氧化性强于Fe3+,与分析一致,可发生,a正确;
b.根据化学方程式分析出:![]() 的氧化性强于Cl2,与分析不一致,不可发生,b错误;
的氧化性强于Cl2,与分析不一致,不可发生,b错误;
c.根据化学方程式分析出:Cl2的氧化性强于![]() ,与分析一致,可发生,c正确;
,与分析一致,可发生,c正确;
故答案为:>;b。


科目:高中化学 来源: 题型:
【题目】中和热测定实验中,下列说法错误的是
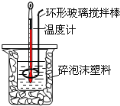
A.一组完整实验数据需要测温度三次
B.可用金属做的环形搅拌棒代替玻璃搅拌棒
C.烧杯间填满碎泡沫塑料是为了减少实验过程中热量散失
D.用0.5molL-1NaOH溶液分别与0.5molL-1的盐酸、硝酸溶液反应,如果所取的溶液体积相等,则测得的中和热数值相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )
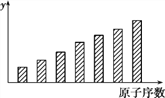
A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 0.1 mol·L-1NaClO溶液中含有的ClO-为NA
B. 1 mol Fe在1 mol Cl2中充分燃烧,转移的电子数为3NA
C. 常温常压下,32 g O2与O3的混合气体中含有的分子总数小于NA
D. 标准状况下,22.4 L HF中含有的氟原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
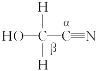
【题目】(1)①丙酮(![]() )分子中碳原子轨道的杂化类型是________,1mol丙酮分子中含有σ键的数目为____________。
)分子中碳原子轨道的杂化类型是________,1mol丙酮分子中含有σ键的数目为____________。
②乙醇的沸点高于丙酮,这是因为__________。
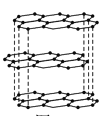
(2)①碳的一种单质的结构如图所示。该单质的晶体类型为______,原子间存在的共价键类型有_______,碳原子的杂化轨道类型为_______________。
②SiCl4分子的中心原子的价层电子对数为_______,分子的立体构型为______,属于______分子(填“极性”或“非极性”)。
③四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图所示。
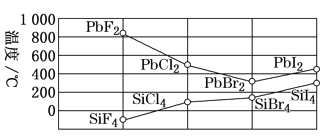
ⅰ.SiX4的沸点依F、Cl、Br、I顺序升高的原因是_____________。
ⅱ.结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I顺序,PbX2中的化学键的离子性_______、共价性_______。(填“增强”“不变”或“减弱”)
(3)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①1 mol HCHO分子中含有σ键的物质的量为______mol。
②HOCH2CN分子中碳原子轨道的杂化类型为_______。
③与H2O分子互为等电子体的阴离子为_______。
④[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H 能正确表示对应物质的燃烧热的是
A.CO2 (g)=CO(g)+![]() O2(g) △H=+283.0kJ·mol-1
O2(g) △H=+283.0kJ·mol-1
B.S(s)+![]() O2(g)=SO3(g) △H=-396kJ·mol-1
O2(g)=SO3(g) △H=-396kJ·mol-1
C.H2(g)+![]() O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
D.CH4(g)+2O2(g) = CO2(g)+2H2O(l) △H =—890.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年,我国科学家研发出一种新型的锌碘单液流电池,已知M为阴离子交换膜,其原理如图所示。下列说法不正确的是
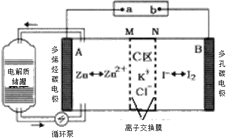
A.放电时A电极反应式为:Zn-2e﹣= Zn2+
B.充电时,B极与外接电源正极相连
C.放电时电解质储罐中离子浓度增大
D.放电时当A极减少65g时,C区Cl﹣增加2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题。已知H—H键的键能为a kJ·mol-1,N—H键的键能为b kJ·mol-1,N≡N键的键能是c kJ·mol-1,则反应NH3(g)![]() N2(g)+
N2(g)+ ![]() H2(g)的ΔH=_______ kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)2NH3(g)的平衡常数K1=_______(用K表示)。
H2(g)的ΔH=_______ kJ·mol-1,若在某温度下其平衡常数为K,则N2(g)+3H2(g)2NH3(g)的平衡常数K1=_______(用K表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ga)与铝同主族,曾被称为“类铝”,其氧化物、氢氧化物均为两性化合物。工业制备镓的流程如图所示。下列判断不合理的是( )
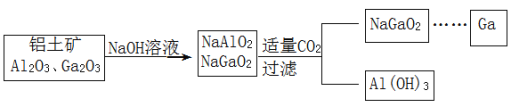
A.Al、Ga均处于ⅢA族
B.Ga(OH)3可与NaOH反应生成 NaGaO2
C.酸性:Al(OH)3>Ga(OH)3
D.Ga2O3可与盐酸反应生成GaCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com