
【题目】扁桃酸衍生物是重要的医药中间体,以A和B为原料合成扁桃酸衍生物F路线如下:
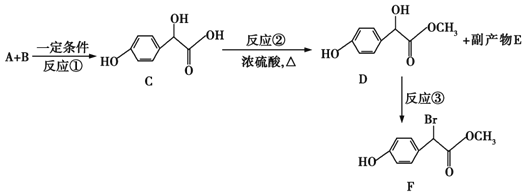
(1)A的分子式为C2H2O3,1molA能消耗含有2.5molCu(OH)2的新制悬浊液,写出A的结构简式______,B的结构简式______。
(2)反应②的反应类型为______反应;请写出反应②的化学方程式_________。
(3)在一定条件下F与足量NaOH溶液反应,1molF最多消耗NaOH的物质的量为______mol。
(4)符合下列条件的F的所有同分异构体(不考虑立体异构)有______种,其中核磁共振氢谱有五组峰的结构简式为______。
①属于一元酸类化合物 ②苯环上只有2个取代基 ③遇FeCl3溶液显紫色
(5)参照上述合成路线,以冰醋酸为原料(无机试剂任选),设计制备A的合成路线:__________。
[已知:RCH2COOH![]() RCH(Cl)COOH]
RCH(Cl)COOH]
【答案】OHCCOOH ![]() 酯化
酯化 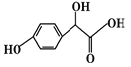 +CH3OH
+CH3OH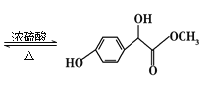 +H2O 3 12
+H2O 3 12 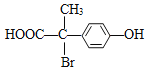 CH3COOH
CH3COOH![]() lCH2COOH
lCH2COOH ![]() HOCH2COONa
HOCH2COONa![]() HOCH2COOH
HOCH2COOH![]() OHCCOOH
OHCCOOH
【解析】
A的分子式为C2H2O3,1 mol A能消耗含有2.5 molCu(OH)2的新制悬浊液,说明A中含有1个-CHO、1个-COOH,为OHCCOOH,根据A、C结构简式知,①为加成反应,B为![]() ,反应②为酯化反应,副产物E为H2O,反应③为取代反应;
,反应②为酯化反应,副产物E为H2O,反应③为取代反应;
(5)以冰醋酸为原料(无机试剂任选),制备OHCCOOH,根据信息知,CH3COOH和PCl3发生取代反应生成ClCH2COOH,ClCH2COOH发生水解反应生成HOCH2COONa,HOCH2COONa酸化得到HOCH2COOH,HOCH2COOH发生氧化反应生成OHCCOOH。
(1)通过以上分析知,A的结构简式OHCCOOH,B的结构简式![]() ;
;
(2)反应②的反应类型为酯化反应,反应②的化学方程式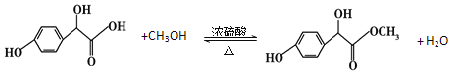 ;
;
(3)F中酚羟基、酯基水解生成的羧基、溴原子水解生成的HBr都能和NaOH发生中和反应,则在一定条件下F与足量NaOH溶液反应,1molF最多消耗NaOH的物质的量为3mol;
(4)F的同分异构体符合下列条件:
①属于一元酸类化合物,说明含有羧基;
②苯环上只有2个取代基;
③遇FeCl3溶液显紫色,说明含有酚羟基;
其中一个取代基是-OH,
如果另一个取代基是-CHBrCH2COOH,有3种;
如果另一个取代基是-CH2CHBrCOOH,有3种;
如果另一个取代基为-CBr(CH3)COOH,有3种;
如果另一个取代基为-CH(CH2Br)COOH,有3种;则符合条件的同分异构体共有12种,其中核磁共振氢谱有五组峰的结构简式为 ;
;
(5)以冰醋酸为原料制备OHCCOOH,根据信息知,CH3COOH和PCl3发生取代反应生成ClCH2COOH,ClCH2COOH发生水解反应生成HOCH2COONa,HOCH2COONa酸化得到HOCH2COOH,HOCH2COOH发生氧化反应生成OHCCOOH,合成路线为CH3COOH![]() lCH2COOH
lCH2COOH ![]() HOCH2COONa
HOCH2COONa![]() HOCH2COOH
HOCH2COOH![]() OHCCOOH。
OHCCOOH。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】在一恒温、恒容的密闭容器中充入一定量的N2O4气体,一段时间后容器中气体颜色逐渐变为红棕色:N2O4(g)![]() 2NO2(g)。下列结论不能说明该反应已经达到化学平衡状态的是( )
2NO2(g)。下列结论不能说明该反应已经达到化学平衡状态的是( )
A.v(N2O4):v(NO2)=1:2
B.容器内气体的压强不再变化
C.容器内气体的颜色不再变化
D.容器内气体的平均相对分子质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:苯甲酸>碳酸>苯酚,现将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与稀H2SO4共热后,加入足量的Na2CO3
B.加入足量的NaOH溶液,再通入足量的HCl
C.与足量的NaOH溶液共热后,再通入CO2
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. 当n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、![]() 的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的aL氯化氢气体溶于100g水中,得到盐酸的密度为bg·mL-1,则该盐酸的物质的量浓度是______________________。
(2)向100mL的FeBr2溶液中通入标准状况下Cl23.36L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为__________________。
(3)FeCl3溶液可以用来净水,其净水的原理为___________________________(用离子方程式表示)。用100mL2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________(填“大于”“等于”或“小于”)0.2NA。
(4)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-bmg/L,现用ClO2将CN-氧化,只生成两种无毒气体,其离子反应方程式为________________,处理100m3这种污水,至少需要ClO2____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
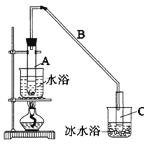
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: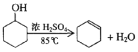
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是:_______________,导管B除了导气外还具有的作用是:_______________。
②试管C置于冰水浴中的目的是。:_______________
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在:_______________层(填上或下),分液后用:_______________ (填入编号)洗涤。
a.KMnO4溶液b.稀H2SO4c.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,如合成的金刚烷胺就是一种抗病毒药剂,对帕金森症、老年痴呆有良好的疗效.由环戊二烯合成金刚烷的路线如下:
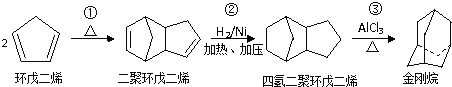
请回答下列问题:
(1)金刚烷的分子式为 ______ .
(2)反应①的反应类型是 ______ .
(3)金刚烷与四氢二聚环戊二烯的关系是 ______ .(填字母)
a 互为同系物 b 互为同分异构体 c 均为烷烃 d 均为环烃
(4)下面是以环戊烷为原料制备环戊二烯的合成路线:
![]()
其中,反应②的反应试剂和反应条件是 ______ ;X的名称是 ______ ;反应④的化学方程式是 ______ ;
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基(-CH3、-CH2R、-CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基],则A的结构有 ______ 种(不考虑立体异构),其中核磁共振氢普为5组峰,且面积比为4:1:2:2:3的结构简式是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行得最快的是( )
2SO3的化学反应速率,其中表示该反应进行得最快的是( )
A.v(SO2)=4mol/(L·min)B.v(O2)=3mol/(L·min)
C.v(SO2)=0.1mol/(L·s)D.v(O2)=0.1mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com