
|
氢离子浓度相同的等体积的两份溶液A和B:A为盐酸,B醋酸.分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是 ①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量不同 ④反应过程的平均速率B>A ⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余 | |
A. |
②④⑤ |
B. |
③④⑥ |
C. |
②③⑤ |
D. |
②③⑤⑥ |
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||


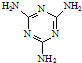 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 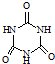 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过| 化合物 | 密度/g?cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| △ |
| △ |
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
查看答案和解析>>
科目:高中化学 来源:湖南省长郡中学2012届高三第五次月考化学试题 题型:043
| |||||||||||
查看答案和解析>>
科目:高中化学 来源:江苏省高淳高级中学2008届高三质量检测化学试卷 题型:022
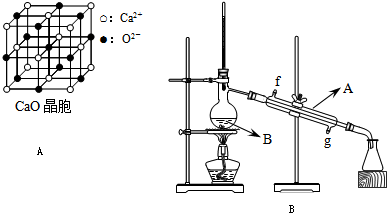
下图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:

(1)上述所列元素的原子中,最外层电子层上只有两个电子的是________(填“元素符号”);
(2)下列叙述正确的是________(填字母序号);
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
(3)根据VSEPR理论预测DA4+离子的空间构型________,ME2的空间构型________;
(4)元素F和元素I形成的化合物是________晶体(填晶体类型),下图为该晶体的结构示意图,请在图中用实心球(●)和空心球(○)分别表示元素F和元素I所在位置.

(5)已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3.
则绿色晶体的化学式为________,该配合物中的配位体为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com