
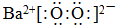 .
.
分析 Ⅰ.(1)依据过氧化钠结构可知过氧化钡中钡离子与过氧根离子通过离子键结合,过氧根中两个氧原子通过共价键结合;
(2)依据题干可知:BaCl2在氨水中与H2O2反应生成BaO2沉淀和氯化铵和水;
(3)反应中+7价锰化合价降为+2价,过氧化钡中-1价氧化升高为氧气中0价,依据氧化还原反应得失电子守恒结合原子个数守恒配比书写方程式;
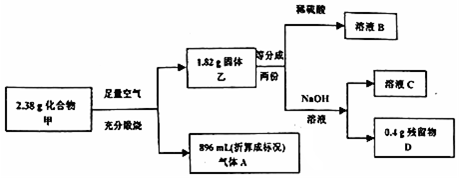
Ⅲ.2.38g化合物甲,在空气中充分煅烧后,得固体残留物乙1.82g和标准状况下896mL即0.04mol气体A,该气体能使品红溶液褪色,加热后品红溶液恢复至原色,所以A是SO2,所得固体残留物乙能全部溶于稀硫酸得溶液B,加KSCN溶液,发现溶液变为血红色,所以B是硫酸铁溶液,固体残留物中存在氧化铁,固体残留物部分溶于NaOH溶液中,所以一定含有氧化铝,固体残留物乙1.82g是氧化铝和氧化铁的混合物,其中Fe2O3是0.8g,Al2O3是1.82g-0.8g=1.02g,据此推断化合物甲中一定含有的元素是Fe、Al、S,n(Al)=$\frac{1.02}{102}×2$=0.02mol,n(Fe)=$\frac{0.8}{160}×2$=0.01mol,n(S)=0.04mol,得到物质的分子式,根据物质的性质进行回答即可.
解答 解:Ⅰ.(1)过氧化钡中,钡离子与过氧根离子通过离子键结合,氧原子之间通过共价键结合,过氧化钡的电子式: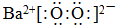 ;
;
故答案为: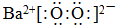 ;
;
(2)BaCl2在氨水中与H2O2反应生成BaO2沉淀和氯化铵和水,离子方程式:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
故答案为:Ba2++H2O2+2NH3•H2O=BaO2+2NH4++2H2O;
(3)反应中+7价锰化合价降为+2价,过氧化钡中-1价氧化升高为氧气中0价,要使得失电子守恒则高锰酸根离子系数为2,过氧化钡系数为5,依据原子个数守恒,反应的方程式:2MnO4-+5BaO2+16H+=2Mn2++5O2↑+5Ba2++8H2O;
故答案为:2;5;16H+;5;2;5;8;
Ⅲ.(4)取少量溶液B,滴加KSCN溶液,发现溶液变为血红色,说明B中含有+3价Fe,反应离子方程式为:Fe3++3SCN-=Fe(SCN)3;故答案为:Fe3++3SCN-=Fe(SCN)3;
(5)氧化铝能与氢氧化钠反应生成溶液C,则反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(6)根据以上分析,A为SO2,B为Fe2(SO4)3,则A通入溶液B中,发生氧化还原的离子反应方程式为:2H2O+2Fe3++SO2=2Fe2++SO42-+4H+,故答案为:2H2O+2Fe3++SO2=2Fe2++SO42-+4H+;
(7)根据以上分析,n(Al)=$\frac{1.02g}{102g/moL}×2$=0.02mol,n(Fe)=$\frac{0.8g}{160g/moL}×2$=0.01mol,n(S)=0.04mol,则化合物甲中n(Fe):n(Al):n(S)=0.005×2:0.01×2:0.04=1:2:4,所以化学式为:FeAl2S4,故答案为:FeAl2S4.
点评 本题考查了电子式、化学方程式书写,以及物质的分子式的计算,注意物质的性质以及发生反应方程式的书写是关键,学会元素守恒思想的应用是重点,难度中等.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:实验题
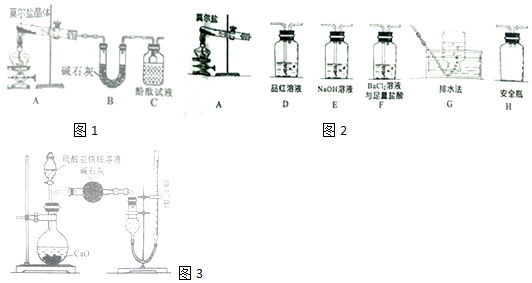
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{mY-XY+2m}{m}$ | B. | Y-X+2 | C. | $\frac{mY+XY-2m}{m}$ | D. | Y-X-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/KJ mol | 803 | 436 | x | 414 | 464 |
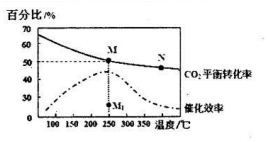
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl.
;与M同一周期的主族元素中原子半径最小的是(填元素符号)Cl. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2AlCl3(熔融)$\frac{\underline{\;电解\;}}{\;}$2Al+3Cl2↑ | |
| B. | 电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++O2↑ | |
| C. | 硫酸氢铵溶液与足量烧碱稀溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 180 kJ | B. | 220 kJ | C. | 240 kJ | D. | 280 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
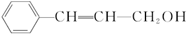 ,则对该有机物的说法正确的是( )
,则对该有机物的说法正确的是( )| A. | 能使溴水、酸性高锰酸钾溶液褪色 | |
| B. | 分子中所有原子在同一平面内 | |
| C. | 分子式为C9H12O | |
| D. | 能发生加成反应、酯化反应、水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com