
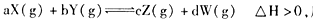 ��Ӧ5min�ﵽƽ��ʱ��X��Сn mol��L-1����Y��ʾ�ķ�Ӧ����Ϊ0.6n mol��L-1��min-1��������ϵѹǿ����W�İٷֺ����������仯��������������ȷ���� �� ��
��Ӧ5min�ﵽƽ��ʱ��X��Сn mol��L-1����Y��ʾ�ķ�Ӧ����Ϊ0.6n mol��L-1��min-1��������ϵѹǿ����W�İٷֺ����������仯��������������ȷ���� �� ��| A�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С��ƽ��������Ӧ�����ƶ� |
| B����Ӧ�и����ʵ�ϵ����a:b:c:d����Ϊ1��3��2��2 |
| C������X��Ũ�ȣ�ƽ��������Ӧ�����ƶ���X��Y��ת���ʶ����� |
| D������ѹǿ��ʹ�ô��������ܸı�÷�Ӧ�����ʺͻ�ѧƽ��״̬ |
 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д� Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
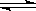 2E(g)������ʼʱֻ����2 mol E(g)����ƽ��ʱ��E��ת����Ϊ40%������ʼʱ����2 mol M��1 mol N�Ļ�����壬��ƽ��ʱ��������ѹǿ����ʼʱ������
2E(g)������ʼʱֻ����2 mol E(g)����ƽ��ʱ��E��ת����Ϊ40%������ʼʱ����2 mol M��1 mol N�Ļ�����壬��ƽ��ʱ��������ѹǿ����ʼʱ������| A��20% | B��40% | C��60% | D��80% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Z(g)����60 s�ﵽƽ�⣬����0.3 mol Z������˵����ȷ���ǣ� ��
Z(g)����60 s�ﵽƽ�⣬����0.3 mol Z������˵����ȷ���ǣ� ��| A����X ��ʾ�Ļ�ѧ��Ӧ����Ϊ0.001 mol/(L��s) |
| B�������������Ϊ20 L��Z��ƽ��Ũ�ȱ�Ϊԭ����1/2 |
| C���������¶�Y��ת���ʼ�С��������ӦΪ���ȷ�Ӧ |
| D���ﵽƽ��ʱ��Y��Z ��Ũ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
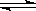 2C��g������2 s ����C��Ũ��Ϊ0.6 mol/L������˵������ȷ���ǣ���������
2C��g������2 s ����C��Ũ��Ϊ0.6 mol/L������˵������ȷ���ǣ����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
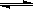 ��H2(g) + CO2(g)��ƽ�ⳣ��K���¶ȵı仯��
��H2(g) + CO2(g)��ƽ�ⳣ��K���¶ȵı仯��| �¶�/�� | 400 | 500 | 830 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)(����ӦΪ���ȷ�Ӧ)����������C�����������ʱ��Ĺ�ϵ��ͼ��ʾ����a��b���߲�ͬ�Ŀ���ԭ����
2C(g)(����ӦΪ���ȷ�Ӧ)����������C�����������ʱ��Ĺ�ϵ��ͼ��ʾ����a��b���߲�ͬ�Ŀ���ԭ���� 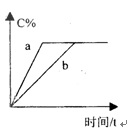
| A��a���¶ȸ���b |
| B��aʹ���˴�������bδ�� |
| C��a��ѹǿ����b |
| D��a���¶ȵ���b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)+H2O(g),�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���£�
CO(g)+H2O(g),�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���£� | t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 3C(g) + D(g)��2���Ӻ�Ӧ�ﵽƽ�⣬C��Ũ��Ϊ1.2 mol/L��
3C(g) + D(g)��2���Ӻ�Ӧ�ﵽƽ�⣬C��Ũ��Ϊ1.2 mol/L���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����| ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
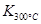 ��
��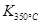 ����÷�Ӧ�� �ȷ�Ӧ��
����÷�Ӧ�� �ȷ�Ӧ��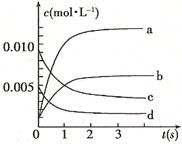
 ״̬����
״̬����  ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com