
| A. | ①④⑤ | B. | ①④⑥ | C. | ②③⑤ | D. | ①②③④⑤⑥ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①单位时间内生成n mol O2等效于消耗2n mol NO2 同时生成2n mol NO2,正逆反应速率相等,达平衡状态,故正确;
②单位时间内生成n mol O2的同时生成2n mol NO,都反映正反应方向,故错误;
③只要反应发生,就符合用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态,故错误;
④混合气体的颜色不再改变的状态,说明二氧化氮的物质的量不变,反应达平衡状态,故正确;
⑤混合气体的密度一直不变,故错误;
⑥混合气体的平均相对分子质量不再改变的状态,说明气体的物质的量不变反应达平衡状态,故正确;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
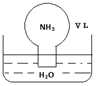 标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )
标准状况下,将体积为V L充满氨气的圆底烧瓶倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法错误的是( )| A. | 水最终会充满整个烧瓶 | |
| B. | 所得溶液的物质的量浓度为 $\frac{1}{22.4}$mol•L-1 | |
| C. | 所得溶液的质量分数为$\frac{17}{22400}$ρ | |
| D. | 将氨气换为二氧化氮,所得溶液的物质的量浓度也为$\frac{1}{22.4}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=13的溶液中能大量存在:Na+、Al3+、Cl-、SO42- | |
| B. | 与金属铝反应有大量气泡产生的无色溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、Na+、Cl- | |
| D. | 溶液通入足量氨气后各离子还能大量存在:K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com