
”¾ĢāÄæ”æŅ»¶ØĢõ¼žĻĀ£¬Ģå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬2mol XŗĶ3mol Y½ųŠŠ·“Ó¦£ŗX£Øg£©+Y£Øg£©![]() Z£Øg£©£¬¾12s“ļµ½Ę½ŗā£¬Éś³É0.6molZ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
Z£Øg£©£¬¾12s“ļµ½Ę½ŗā£¬Éś³É0.6molZ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ŅŌXÅØ¶Č±ä»Æ±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖ0.05 mol/£ØLs£©
B. ĘäĖūĢõ¼ž²»±ä£¬Ōö“óXµÄÅØ¶Č£¬Ę½ŗāÓŅŅĘ£¬XµÄ×Ŗ»ÆĀŹŌö“ó
C. ĘäĖūĢõ¼ž²»±ä£¬12sŗó½«ČŻĘ÷Ģå»żĄ©“óĪŖ10L£¬ZµÄĘ½ŗāÅØ¶Č±äĪŖ0.06mol/L
D. ĘäĖūĢõ¼ž²»±ä£¬ČōŅĘ×ß1molXŗĶ1.5molY£¬ŌŁ“ļĘ½ŗāŹ±ZµÄĪļÖŹµÄĮæŠ”ÓŚ0.3mol
”¾“š°ø”æD
”¾½āĪö”æ
ÓĆČż¶ĪŹ½·ÖĪö£ŗ
X£Øg£©+Y£Øg£©![]() Z£Øg£©
Z£Øg£©
n³õŹ¼£Ømol£© 2 3 0
n×Ŗ»Æ£Ømol£© 0.6 0.6 0.6
nĘ½ŗā£Ømol£© 1.4 2.4 0.6
cĘ½ŗā£Ømol/L£©0.7 1.2 0.3
A”¢øł¾Ż¦Ō=”÷c/”÷t¼ĘĖć³öŅŌXÅØ¶Č±ä»Æ±ķŹ¾µÄ·“Ó¦ĖŁĀŹ£®
B”¢Ōö“óXµÄÅØ¶Č£¬Ę½ŗāÓŅŅĘ£¬XµÄ×Ŗ»ÆĀŹ¼õŠ”£»
C”¢ĘäĖūĢõ¼ž²»±ä£¬12sŗó½«ČŻĘ÷Ģå»żĄ©“óĪŖ10L£¬Ļąµ±ÓŚ¼õŠ”Ń¹Ēæ£¬Ę½ŗāÄęĻņŅĘ¶Æ£»
D”¢Ļąµ±ÓŚ¼õŠ”Ń¹Ēæ£¬Ę½ŗāÄęĻņŅĘ¶Æ£»
ÓĆČż¶ĪŹ½·ÖĪö£ŗ
X£Øg£©+Y£Øg£©![]() Z£Øg£©
Z£Øg£©
n³õŹ¼£Ømol£© 2 3 0
n×Ŗ»Æ£Ømol£© 0.6 0.6 0.6
nĘ½ŗā£Ømol£© 1.4 2.4 0.6
cĘ½ŗā£Ømol/L£©0.7 1.2 0.3
A”¢ŅŌXÅØ¶Č±ä»Æ±ķŹ¾µÄ·“Ó¦ĖŁĀŹ¦Ō=”÷c/”÷t=0.6mol”Ā(2L”Į12s)=0.025 mol/£ØLs£©,¹ŹA“ķĪó”£
B”¢Ōö“óXµÄÅØ¶Č£¬Ę½ŗāÓŅŅĘ£¬XµÄ×Ŗ»ÆĀŹ¼õŠ”£¬¹ŹB“ķĪó£»
C”¢ĘäĖūĢõ¼ž²»±ä£¬12sŗó½«ČŻĘ÷Ģå»żĄ©“óĪŖ10L£¬Ļąµ±ÓŚ¼õŠ”Ń¹Ēæ£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ZµÄĘ½ŗāÅØ¶ČŠ”ÓŚ0.06mol”¤L£1£¬¹ŹC“ķĪó£»
D”¢Ļąµ±ÓŚ¼õŠ”Ń¹Ēæ£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŌŁ“ļĘ½ŗāŹ±ZµÄĪļÖŹµÄĮæŠ”ÓŚ0.3mol£¬¹ŹDÕżČ·£»
¹ŹŃ”D”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹŅĪĀĻĀ£¬µ„ÖŹA”¢B”¢C·Ö±šĪŖ¹ĢĢ唢»ĘĀĢÉ«ĘųĢ唢ĪŽÉ«ĘųĢ壬ŌŚŗĻŹŹµÄ·“Ó¦Ģõ¼žĻĀ£¬ĖüĆĒæÉŅŌ°“ĻĀĆęæņĶ¼½ųŠŠ·“Ó¦£¬ÓÖÖŖEČÜŅŗŹĒĪŽÉ«µÄ£¬Ēė»Ų“š£ŗ
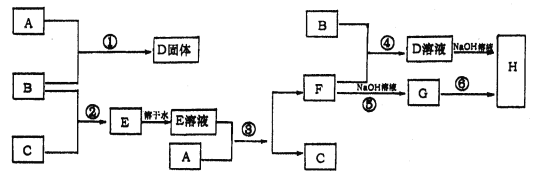
(1)AŹĒ_____________£¬BŹĒ______________£¬CŹĒ___________£ØĢī»ÆѧŹ½£©
(2)·“Ó¦¢ŽµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ__________________________________________”£
(3)·“Ó¦¢ÜµÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ__________________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌÓŚ·“Ó¦£ŗ2SO2£«O2![]() 2SO3£¬µ±ĘäĖūĢõ¼ž²»±äŹ±£¬Ö»øıäŅ»øöĢõ¼ž£¬½«Éś³ÉSO3µÄ·“Ó¦ĖŁĀŹµÄ±ä»ÆĢīČėĻĀ±ķøńĄļ£ØĢī”°Ōö“ó”±”¢”° ¼õŠ””±»ņ”°²»±ä”±£©”£
2SO3£¬µ±ĘäĖūĢõ¼ž²»±äŹ±£¬Ö»øıäŅ»øöĢõ¼ž£¬½«Éś³ÉSO3µÄ·“Ó¦ĖŁĀŹµÄ±ä»ÆĢīČėĻĀ±ķøńĄļ£ØĢī”°Ōö“ó”±”¢”° ¼õŠ””±»ņ”°²»±ä”±£©”£
±ąŗÅ | øıäµÄĢõ¼ž | Éś³ÉµÄSO3µÄĖŁĀŹ |
¢Ł | ½µµĶĪĀ¶Č | _______ |
¢Ś | ÉżøßĪĀ¶Č | _______ |
¢Ū | Ōö“óO2µÄÅØ¶Č | _______ |
¢Ü | ŗćČŻĻĀ³äČėNe | _______ |
¢Ż | Ń¹ĖõĢå»ż | _______ |
¢Ž | Ź¹ÓĆ“ß»Æ¼Į | _______ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅÖŠÓŠŅ»Ī“ÖŖÅØ¶ČµÄ“×Ėį£¬Ä³Ń§ÉśÓĆ0.1000 mol”¤L-1 NaOH±ź×¼ČÜŅŗ½ųŠŠ²ā¶Ø“×ĖįµÄÅØ¶ČµÄŹµŃé£¬Č”20.00mL“ż²ā“×Ėį·ÅČė׶ŠĪĘæÖŠ£¬²¢µĪ¼Ó2~3µĪÖøŹ¾¼Į£¬ÓĆNaOH±ź×¼ČÜŅŗ½ųŠŠµĪ¶Ø”£ÖŲø“ÉĻŹöµĪ¶Ø²Ł×÷2~3“Ī£¬¼ĒĀ¼Źż¾ŻČēĻĀ”£Ķź³ÉĻĀĮŠĢīæÕ£ŗ
ŹµŃ鱹ŗÅ | “ż²ā“×ĖįµÄĢå»ż/mL | NaOHČÜŅŗµÄÅضČ/mol”¤L-1 | ĻūŗÄNaOHČÜŅŗµÄĢå»ż/mL |
1 | 20.00 | 0.1000 | 25.18 |
2 | 20.00 | 0.1000 | 23.06 |
3 | 20.00 | 0.1000 | 22.98 |
£Ø1£©øĆŹµŃéÖŠÖøŹ¾¼Į×īŗĆŃ”ÓĆ___________£¬µĪ¶Ø“ļµ½ÖÕµćµÄ±źÖ¾ŹĒ_____________________”£
£Ø2£©Åųż¼īŹ½µĪ¶Ø¹Ü¼ā×ģÖŠĘųÅŻµÄ·½·ØÓ¦²ÉÓĆŅŌĻĀ_________²Ł×÷£ØĢī¼×/ŅŅ/±ū£©£¬Č»ŗóĒįĒį¼·Ń¹²£Į§ĒņŹ¹¼ā×ģ²æ·Ö³äĀś¼īŅŗ”£

£Ø3£©øł¾ŻÉĻŹöŹż¾Ż£¬æɼĘĖć³öøĆ“×ĖįµÄÅضČĪŖ_________mol”¤L-1£Ø±£ĮōŠ”Źżµćŗó4Ī»£©”£
£Ø4£©ŌŚÉĻŹöŹµŃéÖŠ£¬ĻĀĮŠ²Ł×÷£ØĘäĖū²Ł×÷ÕżČ·£©»įŌģ³É²ā¶Ø½į¹ūĘ«øßµÄÓŠ________”£
A£®ÓƵĪ¶Ø¹ÜČ”20.00mL“ż²ā“×Ėį£¬Ź¹ÓĆĒ°£¬Ė®Ļ“ŗóĪ“ÓĆ“ż²ā“×ĖįČóĻ“
B£®×¶ŠĪĘæĖ®Ļ“ŗóĪ“øÉŌļ
C£®³ĘĮæNaOH¹ĢĢåŹ±£¬ÓŠŠ”²æ·ÖNaOH³±½ā
D£®µĪ¶ØÖÕµć¶ĮŹżŹ±ø©ŹÓ
E£®¼īŹ½µĪ¶Ø¹Ü¼ā×ģ²æ·ÖÓŠĘųÅŻ£¬µĪ¶ØŗóĻū¹Ų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČżĀČ»ÆĢśŌŚÓ”Ė¢”¢Ņ½Ņ©”¢ŃÕĮĻ”¢ĪŪĖ®“¦ĄķŅŌ¼°ÓŠ»śŗĻ³É“߻ƼĮ·½ĆęÓŠÖŲŅŖµÄÓ¦ÓĆ”£¹¤ŅµÉĻ³£ŅŌ·ĻĢśŠ¼£Øŗ¬ÓŠSiO2”¢Al2O3”¢MgO”¢Fe2O3µČŌÓÖŹ£©ĪŖŌĮĻÖʱøĀČ»ÆĢś”£ĘäÉś²śĮ÷³ĢČēĶ¼£ŗ
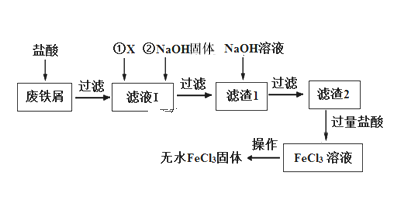
ŅŃÖŖ£ŗĒāŃõ»ÆĪļµÄKspČēĻĀ±ķ£ŗ
ĒāŃõ»ÆĪļ | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0”Į10-36 | 1.6”Į10-14 | 2.0”Į10-33 | 1.2”Į10-11 |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĪļÖŹXæÉŅŌŃ”ÓĆĻĀĮŠĪļÖŹÖŠµÄ____£ØŃ”ĢīŠņŗÅ£©
A£®NaCl B£®FeCl3 C£®H2O2 D£®H2SO4
£Ø2£©ĀĖŅŗ¢ń¼ÓČėNaOH¹ĢĢåµÄÄæµÄŹĒµ÷½ŚČÜŅŗµÄpH£ØŗöĀŌ¼ÓČėNaOH¹ĢĢåŅŌŗóČÜŅŗĢå»żµÄ±ä»Æ£©”£ŅŃÖŖĀĖŅŗ¢ńÖŠc(Fe3+)ĪŖ1.0 mol”¤L-1£¬c(Al3+)ĪŖ0.03 mol”¤L-1£¬c(Mg2+)ĪŖ0.01 mol”¤L-1£¬µ±Fe3+Ē”ŗĆ³ĮµķĶźČ«Ź±[c(Fe3+)=1”Į10-5 mol”¤L-1]£¬Al3+ŹĒ·ńŅŃ¾æŖŹ¼³Įµķ______£ØĢī”°ŹĒ”±»ņ”°·ń”±£©”£
£Ø3£©Š“³öĀĖŌü1¼ÓNaOHČÜŅŗ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½_____________________”£
£Ø4£©Éś²śĮ÷³ĢÖŠ×īŗó”°“ÓFeCl3ČÜŅŗµĆµ½ĪŽĖ®FeCl3¹ĢĢå”±µÄ²Ł×÷·ÖĪŖĮ½²½£ŗµŚŅ»²½£¬ĻČĄäČ“½į¾§µĆµ½FeCl3”¤6H2O¾§Ģ壻µŚ¶ž²½£¬ÖĘĪŽĖ®FeCl3¹ĢĢ唣µŚ¶ž²½µÄÕżČ·²Ł×÷ŹĒ_____”£
£Ø5£©FeCl3¾ßÓŠ¾»Ė®×÷ÓĆ£¬µ«Ņ×øÆŹ“Éč±ø£¬¶ų¾ŪŗĻĀČ»ÆĢśŹĒŅ»ÖÖŠĀŠĶµÄŠõÄż¼Į£¬“¦ĄķĪŪĖ®±ČFeCl3øߊ§£¬ĒŅøÆŹ“ŠŌŠ””£
¢ŁFeCl3¾»Ė®µÄŌĄķŹĒ____________________£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©
¢ŚĶعżæŲÖĘĢõ¼žÉś³É¾ŪŗĻĀČ»ÆĢś£¬Ąė×Ó·½³ĢŹ½ĪŖxFe3£«£«yH2O![]() Fex(OH)y(3x-y)+£«yH£«£¬ÓūŌö¼Ó¾ŪŗĻĀČ»ÆĢśµÄ²śĀŹæɲÉČ”µÄ·½·ØŹĒ_____£ØĢī×ÖÄø£©”£
Fex(OH)y(3x-y)+£«yH£«£¬ÓūŌö¼Ó¾ŪŗĻĀČ»ÆĢśµÄ²śĀŹæɲÉČ”µÄ·½·ØŹĒ_____£ØĢī×ÖÄø£©”£
a£®½µĪĀ”” b£®¼Ó°±Ė® c£®¼ÓČėNH4Cl d£®¼ÓČėNaHCO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶Ō¼×ĶéŗĶĀČĘųµÄ·“Ó¦£ØČēĶ¼ĖłŹ¾£©ŠšŹö²»ÕżČ·µÄŹĒ£Ø””””£©
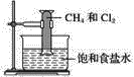
A.øĆ·“Ó¦ŹōÓŚČ”“ś·“Ó¦
B.øĆ·“Ó¦µÄĢõ¼žŹĒ¹āÕÕ
C.øĆ·“Ó¦µÄÉś³ÉĪļÓŠĖÄÖÖ
D.·“Ó¦ŗóĮæĶ²ÄŚŅŗĆęÉĻÉż²¢²śÉś°×Īķ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ęĻĀ£¬Čõµē½āÖŹµÄµēĄėĘ½ŗā³£Źż![]() £¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.ÓĆ0.1mol/LµÄŃĪĖįµĪ¶Ø0.1mol/LµÄ°±Ė®Ź±£¬æÉÓĆ·ÓĢŖ×÷ÖøŹ¾¼Į
B.0.2mol/LµÄ“×ĖįÓė0.1mol/LµÄĒāŃõ»ÆÄĘČÜŅŗµČĢå»ż»ģŗĻ£¬ĖłµĆČÜŅŗÖŠ£ŗ![]()
C.pH=3µÄŃĪĖįÓėpH=11µÄ°±Ė®µČĢå»ż»ģŗĻ£¬ĖłµĆČÜŅŗÖŠ![]()
D.pH=3µÄ“×ĖįÓėpH=11µÄ°±Ė®µČĢå»ż»ģŗĻ£¬ĖłµĆČÜŅŗÖŠÓÉĖ®µēĄė³öµÄ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijģÄā"ČĖ¹¤Ź÷Ņ¶”±µē»ÆѧŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£¬øĆ×°ÖĆÄܽ«H2OŗĶCO2×Ŗ»ÆĪŖO2ŗĶČ¼ĮĻ(C3H8O)”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
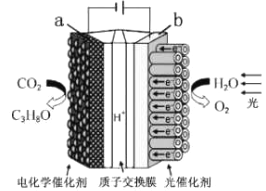
A. øĆ×°ÖĆ½«»ÆѧÄÜ×Ŗ»ÆĪŖ¹āÄÜŗĶµēÄÜ
B. øĆ×°ÖĆ¹¤×÷Ź±£¬H£«“Ób¼«ĒųĻņa¼«ĒųĒØŅĘ
C. ĆæÉś³É1 mol O2£¬ÓŠ44 gCO2±»»¹Ō
D. aµē¼«µÄ·“Ó¦ĪŖ£ŗ3CO2+ 16H£«-18e£= C3H8O+4H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ“óŹŌ¹ÜÄŚ½«×ćĮæNaHCO3¼ÓČȵ½ 200”ę£¬½«²śÉśµÄ»ģŗĻĘųĢåĶØČėµ½Ź¢ÓŠ1.87 g Na2OŗĶNa2O2µÄĆܱÕČŻĘ÷ÖŠ£¬“żNa2OŗĶNa2O2Č«²æ·“Ó¦ŗó£¬µĆµ½±ź×¼×“æöĻĀ224 mL O2£»ŌŁ½«·“Ó¦ŗóĆܱÕČŻĘ÷ÄŚµÄ¹ĢĢåČ«²æČÜÓŚĖ®Åä³É 100 mL ČÜŅŗ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A.Na2OŗĶNa2O2 ¾łĪŖ¼īŠŌŃõ»ÆĪļ
B.²Ī¼Ó·“Ó¦µÄNaHCO3ĪļÖŹµÄĮæĪŖ 0.04 mol
C.·“Ó¦¹ż³ĢÖŠ×ܹ²×ŖŅĘ 0.04 mol µē×Ó
D.Åä³ÉµÄ 100 mL ČÜŅŗÖŠ c(Na+) = 0.5 mol/L
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com