
| A、在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B、基态Fe原子的外围电子排布图为: |
| C、因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D、根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
 ,故B正确;
,故B正确;

 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
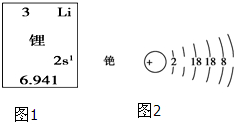 碱金属元素在科学研究与生产生活中有着非常广泛的用途.
碱金属元素在科学研究与生产生活中有着非常广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:
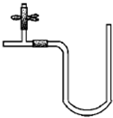 “阿波罗登月计划”总指挥韦伯在“阿波罗”登月成功后曾说:“阿波罗计划”中没有一项新发明的技术,都是现成的技术,关键在于综合.综合也是创新,例如可以用玻璃管制成的U形管、T形管、乳胶管、弹簧夹连接成如图所示的一种装置,在U型管中加入适量的红色溶液,即得简单U型气压计,我们可将它应用于多项实验,如:A.证明空气中的氧气参与氧化还原反应的实验(如铁生锈);B.溶解热效应实验(如硝酸铵溶于水);C.装置的气密性检验实验;D.检验某些气体性质的实验(如CO2,SO2、Cl2等与碱溶液的反应)等等.
“阿波罗登月计划”总指挥韦伯在“阿波罗”登月成功后曾说:“阿波罗计划”中没有一项新发明的技术,都是现成的技术,关键在于综合.综合也是创新,例如可以用玻璃管制成的U形管、T形管、乳胶管、弹簧夹连接成如图所示的一种装置,在U型管中加入适量的红色溶液,即得简单U型气压计,我们可将它应用于多项实验,如:A.证明空气中的氧气参与氧化还原反应的实验(如铁生锈);B.溶解热效应实验(如硝酸铵溶于水);C.装置的气密性检验实验;D.检验某些气体性质的实验(如CO2,SO2、Cl2等与碱溶液的反应)等等.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、①③ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 | 若溶液颜色明显改变,且有 |
| 步骤2:将步骤1中得到浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:取步骤2得到的少量固体于试管中滴加 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 玻璃仪器 |
| A | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管 |
| B | 用碱石灰除去氢气中混有的水蒸气并收集氢气 | 洗气瓶、导气管、集气瓶 |
| C | 用氢氧化钠和醋酸溶液测中和反应的中和热 | 烧杯、环形玻璃搅拌棒、温度计 |
| D | 分离乙醇和苯酚的混合物 | 分液漏斗、烧杯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| U | ||
| Y |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入He的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com