
 |
| A.氨水 | B.氢氧化钠 | C.生石灰 | D.双氧水 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
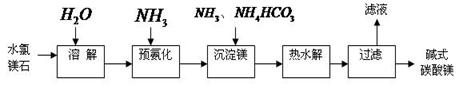
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
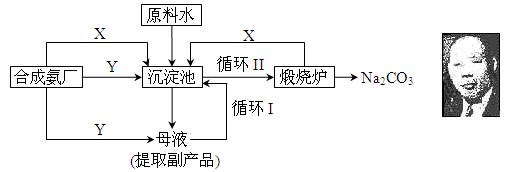
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 O
O  Na2CO3
Na2CO3 +CO2↑+H2O
+CO2↑+H2O  所以在溶液中首先结晶析出
所以在溶液中首先结晶析出 碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。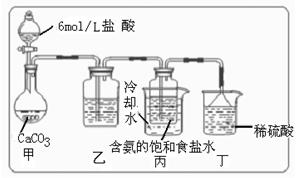
 (Ⅰ)乙装置中的试剂是
(Ⅰ)乙装置中的试剂是 
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 处新建一座硫酸厂,你认为厂址宜选在 的郊区(填选项的标号)
处新建一座硫酸厂,你认为厂址宜选在 的郊区(填选项的标号)| A.有丰富黄铁矿资源的城市 | B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 | D.人口稠密的文化、商业中心城市 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
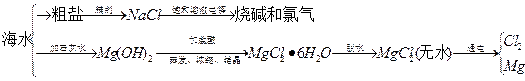
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
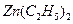 .
.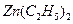 可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌的方法______。
可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌的方法______。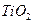 ) 替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分
) 替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分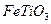 ),为原料按下过程进行的,请
),为原料按下过程进行的,请 完成下列化学方程式
完成下列化学方程式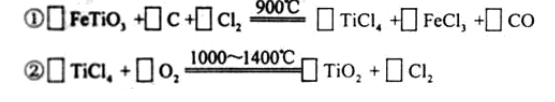
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com