
(8分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2—3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1Na2S2O3溶液(显碱性),调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2 + 2Na2S2O3 = 2NaI + Na2S4O6。
试完成下列问题:
(1)步骤①加入的指示剂是____________________。
(2)步骤②应使用____________式滴定管。
(3)步骤③当待测液由___________色变为__________色且不再变化即达终点,若耗去Na2S2O3溶液40.00 mL,则废水中Cl2的物质的量浓度为__________________________。
(4)以上实验步骤中有一处明显的操作错误,请指出.
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
(9分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2—3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1Na2S2O3溶液(显碱性),调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3====2NaI+Na2S4O6。
试完成下列问题:
(1)步骤①加入的指示剂是____________________。
(2)步骤②应使用__________式滴定管。
(3)步骤③当待测液由___________色变为__________色且不再变化即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为____________________。
(4)Cl2的实际浓度比所测浓度应_____________(“偏大”“偏小”或“相等”),造成误差的原因是_______________________________。(若认为没有误差,此问不答)
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00mL于锥形瓶中,加入10.00mL KI溶液(足量),滴入指示剂2~3滴。
②取一只碱式滴定管依次用自来水、蒸馏水洗净,然后注入0.010 mol·L-1 Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是 。
(2)滴定时,眼睛应注视____________________,
判断到达滴定终点的现象是 ,
若耗去Na2S2O3溶液20.00mL,则废水中Cl2的物质的量浓度为__________________。
(3)Cl2的实际浓度比所测浓度应__________________(“偏大”、“偏小”或“相等”),造成误差的原因是 。(若认为没有误差,此问不答)
(4)右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度为25,滴定管中液面读数应为 mL,设此时液体体积读
数为a ml ,滴定管中液体的体积 V (=、>、<) ( 50-a )ml
(5)滴定结束时俯视刻度线读取滴定终点时Na2S2O3溶液的体积,会导致测定结果 (“偏大”、“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省余姚中学高二下学期第一次质量检测化学试卷 题型:填空题
某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00mL于锥形瓶中,加入10.00mL KI溶液(足量),滴入指示剂2~3滴。
②取一只碱式滴定管依次用自来水、蒸馏水洗净,然后注入0.010 mol·L-1 Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是 。
(2)滴定时,眼睛应注视____________________,
判断到达滴定终点的现象是 ,
若耗去Na2S2O3溶液20.00mL,则废水中Cl2的物质的量浓度为__________________。
(3)Cl2的实际浓度比所测浓度应__________________(“偏大”、“偏小”或“相等”),造成误差的原因是 。(若认为没有误差,此问不答)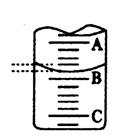
(4)右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的 刻度为25,滴定管中液面读数应为 mL,设此时液体体积读
数为a ml ,滴定管中液体的体积 V (=、>、<) ( 50-a )ml
(5)滴定结束时俯视刻度线读取滴定终点时Na2S2O3溶液的体积,会导致测定结果 (“偏大”、“偏小”或“不影响”)。
查看答案和解析>>
科目:高中化学 来源:2012届辽宁省高二下学期期中考试化学试卷 题型:实验题
(9分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2—3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1Na2S2O3溶液(显碱性),调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3====2NaI+Na2S4O6。
试完成下列问题:
(1)步骤①加入的指示剂是____________________。
(2)步骤②应使用__________式滴定管。
(3)步骤③当待测液由___________色变为__________色且不再变化即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为____________________。
(4)Cl2的实际浓度比所测浓度应_____________(“偏大”“偏小”或“相等”),造成误差的原因是_______________________________。(若认为没有误差,此问不答)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com