
| A. | 常温下,pH均等于4的硫酸溶液与醋酸溶液,两种溶液中c(SO42-)与c(CH3COO-)之比为1:2 | |
| B. | 常温下,向pH=4.0的醋酸溶液中加入水稀释后,溶液中c(H+)和c(OH-)都将变小 | |
| C. | 常温下,0.1mol/L NaHA溶液的PH=5,溶液:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) |
分析 A.常温下,pH均等于4的硫酸溶液与醋酸溶液中氢离子浓度相同,结合电离出的氢离子浓度和硫酸根离子、醋酸根离子浓度关系分析;
B.醋酸溶液加水稀释促进电离,平衡状态下的微粒浓度减小,溶液中存在离子积常数分析氢离子浓度和氢氧根离子浓度;
C.常温下,0.1mol/L NaHA溶液的PH=5,溶液显酸性;
D.0.1mol•L-1的(NH4)2Fe(SO4)2溶液中铵根离子、亚铁离子水解溶液显酸性.
解答 解:A.常温下,pH均等于4的硫酸溶液与醋酸溶液中氢离子浓度相同,结合电离出的氢离子浓度和硫酸根离子、醋酸根离子浓度关系,H2SO4=2H++SO42-,CH3COOH?CH3COO-+H+,两种溶液中c(SO42-)与c(CH3COO-)之比为1:2,故A正确;
B.醋酸溶液加水稀释促进电离,平衡状态下的微粒浓度减小,溶液中存在离子积常数分析,氢离子浓度减小,氢氧根离子浓度增大,故B错误;
C.常温下,0.1mol/L NaHA溶液的PH=5,溶液显酸性,HA-电离程度大于水解程度,溶液中离子浓度大小为:c(HA-)>c(A2-)>c(H+)>c(H2A),故C错误;
D.0.1mol•L-1的(NH4)2Fe(SO4)2溶液中铵根离子、亚铁离子水解溶液显酸性,c(SO42-)>c(NH4+)>c(Fe2+)>c(H+),故D错误;
故选A.
点评 本题考查了电解质溶液中离子浓度大小比较,主要是盐类水解原理应用、弱电解质电离和影响因素的判断,题目难度中等.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:选择题
| A. |
| |||||||||
| B. |
| |||||||||
| C. | 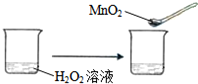 | |||||||||
| D. | 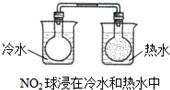 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.1mol H2SO4的浓硫酸与含0.2 mol NaOH的溶液混合,放出的热量即为中和热 | |
| B. | 化学键断裂时吸收能量,形成时放出能量 | |
| C. | 增大反应物的浓度,可增加单位体积内活化分子数,从而使反应速率增大 | |
| D. | 为了防止轮船的钢铁外壳被腐蚀,可以在外壳上连接锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4与稀硝酸反应:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入少量KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| B. | 淀粉和蛋白质水解的最终产物都能发生银镜反应 | |
| C. | 油脂都是高级脂肪酸甘油酯,在碱性条件下能发生皂化反应 | |
| D. | “乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Ca2+、HCO3- | B. | NO3-、Cl-、Na+、Ag+ | ||
| C. | Cu2+、Fe2+、SO42-、Cl- | D. | Mg2+、Na+、Cl-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
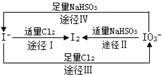
| A. | 由图可知离子还原性的强弱顺序为HSO3->I->Cl- | |
| B. | 足量Cl2能使湿润的淀粉-KI试纸先变蓝后变白 | |
| C. | 途径Ⅱ、Ⅳ反应后溶液的pH均减小 | |
| D. | 途径Ⅲ中若氧化1 mol I-,需消耗67.2L氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com