


科目:高中化学 来源:不详 题型:单选题
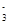 与R-可发生反应:RO
与R-可发生反应:RO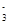 +5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )| A.元素R位于周期表中第ⅤA族 |
B.RO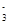 中的R只能被还原 中的R只能被还原 |
C.若1mol RO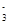 参与该反应,则转移的电子的物质的量为5mol 参与该反应,则转移的电子的物质的量为5mol |
| D.R2在常温常压下一定是气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Cr2O72-+ H2O
Cr2O72-+ H2O| A.铁 | B.氧化铝 | C.石英 | D.陶瓷 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.+2 | B.+3 | C.+4 | D.+5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
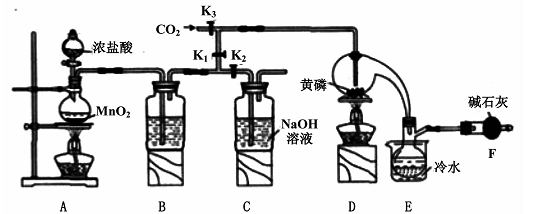

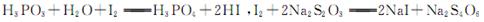 已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。
已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.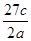 | B.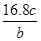 | C. | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2LiH+2Al+3H2↑
2LiH+2Al+3H2↑| A.LiAlH4是共价化合物,LiH是离子化合物 |
| B.生成等质量的氢气,反应①、②转移电子数之比为4?3 |
| C.氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑ |
| D.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com