6.亚硫酸钠在印染、造纸等众多行业中有着广泛的应用.研究小组用Na
2CO
3溶液吸收SO
2制备Na
2SO
3.其实验流程如图1
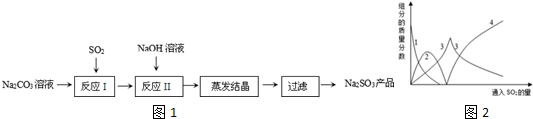
查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如图2是所示.
(1)图2中的线2表示的组分为NaHCO
3(填化学式)
(2)实验时,“反应II”中加入NaOH溶液的目的是NaHSO
3+NaOH=Na
2SO
3+H
2O(主要)SO
2+2NaOH=Na
2SO
3+H
2O(次要)(用化学方程式表示)
(3)国家标准规定产品中Na
2SO
3的质量分数≥97.0%为优等品,≥93.0%为一等品.为了确定实验所得产品的等级,研究小组采用了两种方法进行测定.
①方法I:称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na
2SO
3完全氧化生成Na
2SO
4,再加入过量的BaCl
2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,通过计算确定产品中Na
2SO
3的质量分数m(BaSO
4)=4.660g,n(BaSO
4)=$\frac{4.660g}{233g/mol}$=0.020mol,则经氧化后n(Na
2SO
4)=0.020mol,m(Na
2SO
4)=0.020mol×142g/mol=2.840g,根据差量法,原混合物中的Na
2SO
3:n(Na
2SO
3)=$\frac{2.840g-2.570g}{16g/mol}$,m(Na
2SO
3)=$\frac{2.840g-2.570g}{16g/mol}$×126g/mol=2.12625g,w(Na
2SO
3)=$\frac{2.1262g}{2.570g}$×100%≈82.73%.
如若不考虑杂质,则n(Na
2SO
3)=n(BaSO
4)=0.020mol,
m(Na
2SO
3)=0.020mol×126g/mol=2.520g,
w(Na
2SO
3)=$\frac{2.520g}{2.570g}$×100%≈98.05%.(写出计算过程)
②方法II:称取1.326g产品,配成100mL溶液,取25.00mL该溶液,滴加0.1250mol/L I
2溶液,恰好使Na
2SO
3完全氧化生成Na
2SO
4时,消耗I
2溶液20.00mL.通过计算确定产品中Na
2SO
3的质量分数n(Na
2SO
3)=n(I
2)=20.00mL×10
-3L/mL×0.1250mol/L=0.0025mol,m(Na
2SO
3)=0.0025mol×126g/mol×$\frac{100ml}{2500ml}$=1.260g,
w(Na
2SO
3)=$\frac{1.260g}{1.326g}$×100%≈95.02%.(写出计算过程)
③判断Na
2SO
3产品的等级,并说明理由方案I中的产品为优等品,方案II中的产品为一等品.但是方案I产品中含有的硫酸钠和碳酸钠等杂质,在方案I的测定中,硫酸钠和碳酸钠杂质对测定有干扰,而方案II是直接测定亚硫酸钠,可信度和精确度都要更高一些.