
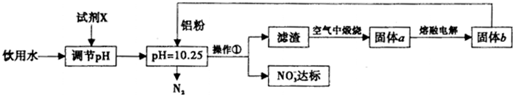
分析 试剂X为Ca(OH)2,选用Ca(OH)2调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,在pH=10.25时加入铝粉,与NO3-发生氧化还原反应生成氮气和氢氧化铝,煅烧生成氧化铝,电解可生成铝,
(1)pH过大或过小,加入的铝粉会反应生成H2,造成Al的利用率降低.选用Ca(OH)2调节pH较合适,因引入的Ca2+对人体无害,且来源丰富,价格便宜;
(2)操作①是过滤;
(3)根据流程的信息可知,铝粉还原溶液中NO3-生成N2,同时生成难溶物Al(OH)3;
(4)H2还原NO3-也生成N2(空气的主要成分).
解答 解:试剂X为Ca(OH)2,选用Ca(OH)2调节pH,原料来源丰富,价格便宜,且引人离子对人体无害,在pH=10.25时加入铝粉,与NO3-发生氧化还原反应生成氮气和氢氧化铝,煅烧生成氧化铝,电解可生成铝,
(1)pH过大或过小,加入的铝粉会反应生成H2,造成Al的利用率降低.选用微溶的Ca(OH)2调节溶液的pH较合适,因引入的Ca2+对人体无害,且来源丰富,价格便宜,故答案为:B;
(2)流程中操作①用于分离固体和液体,为过滤操作,用到的仪器有烧杯、漏斗、玻璃棒,故答案为:过滤; 烧杯、漏斗、玻璃棒;
(3)铝粉与硝酸根离子发生氧化还原反应生成固体,则固体为氢氧化铝,则硝酸被还原为氮气,则在溶液中铝粉和NO3-反应的离子方程式为10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-,
故答案为:10Al+6NO3-+18H2O═10Al(OH)3↓+3N2↑+6OH-;
(4)H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3-+2H+$\frac{\underline{\;催化剂\;}}{\;}$N2+6H2O,
故答案为:5;2;2H+;N2;6.
点评 本题以信息的形式考查氧化还原反应、离子反应,侧重于学生的分析、实验能力的考查,为高频考点和常见题型,注重对化学用语的考查,注意知识与题目信息的结合来解答,对学生能力要求较高,题目难度中等.


科目:高中化学 来源: 题型:选择题
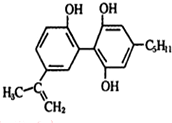 ,有关该物质的说法正确的是( )
,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4酸性溶液,观察到紫色褪去,可证明分子中存在双键 | |
| C. | 1mol该物质与足量的碳酸氢钠反应,产生3molCO2 | |
| D. | 1 mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4 mol、7 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- | |
| B. | 水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- | |
| C. | 无色透明溶液中:Al3+、Ca2+、Cl-、HCO3- | |
| D. | 含大量Fe3+的溶液中:K+、I-、NH4+、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有害垃圾 | B. | 不可回收垃圾 | C. | 可回收垃圾 | D. | 可堆肥垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释( ) |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C═O是极性键 |
| C | H2O的稳定性大于H2S | H2O分子间有氢键 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4aVL | B. | $\frac{22.4aV}{(1-22.4a)}$ | ||
| C. | $\frac{22400aV}{(1000d-17a)L}$ | D. | $\frac{22400aV}{(1000d+17a)L}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
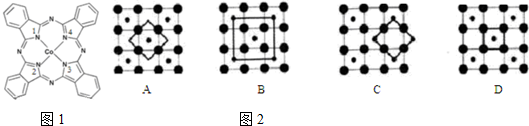
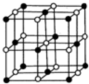 ),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D.
),在该晶体中与一个钴原子等距离且最近的钴原子有12个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如2所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是D.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外界条件不能改变平衡状态 | B. | 达平衡时正、逆反应速率相等 | ||
| C. | 各组分的含量不随时间而变化 | D. | 是动态平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| D. | Na2O和Na2O2投入水中都能生成NaOH,都是氧化还原反应,它们都是碱性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com