
【题目】已知:通常状况下甲、乙、丙、丁为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③是工业制H的重要化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。请回答下列问题:

(1)请指出G的颜色和状态 。单质乙的电子式为 。D属于 (填“离子化合物”或“共价化合物”)
(2)B和E在一定条件下可发生反应,该反应具有实际意义,可消除E对环境的污染,该反应中氧化产物与还原产物的物质的量之比为 。
(3)惰性电极电解A和D的混合溶液,可生成丁单质和一种二元化合物M(与甲、乙所含元素相同),M为三角锥形分子,该反应的方程式为 。在碱性溶液中M与NaClO2(亚氯酸钠)按物质的量之比1∶6恰好反应可生成化合物B和消毒剂ClO2气体,该反应的离子方程式为 。
(4)反应④的化学方程式为 。
(5)将Fe、FeO、Fe3O4的混合物二等分,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解,且放出336mL(标况下)的气体,向所得溶液中加入KSCN溶液,溶液不变红;另一份混合物加入1 mol/ L 的H溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,则所加入的H溶液的体积是 mL。
【答案】(1)红棕色气体 ![]() 离子化合物(2)3:2
离子化合物(2)3:2
(3)2HCl+NH4Cl![]() NCl3+3H2↑ NCl3+3H2O+ClO2—=ClO2↑+3Cl-+3OH-+3NH3↑
NCl3+3H2↑ NCl3+3H2O+ClO2—=ClO2↑+3Cl-+3OH-+3NH3↑
(4)2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O;(5)100ml
【解析】
试题解析: C为常见液体,则C可能是水。通常状况下甲、乙、丙、丁等为气体单质,则丙和丁应该是氢气和氧气。A和B都是化合物,且都是气体。又因为A和B可以反应生成D,D和F反应生成B、C、I,且该反应是重要的实验室制取气体的反应,由此可以推测,该反应是实验室制取氨气的反应,所以丁是氢气,丙是氧气,B能和氧气反应生成水和E,所以B是氨气,则乙是氮气,A是氯化氢,甲是氯气,D是氯化铵,F是氢氧化钙,I是氯化钙。E是NO,G是NO2,NO2溶于水生成硝酸和NO,则H是硝酸。(1)NO2红棕色气体;。单质氮气的电子式为:![]() ;D是氯化铵属于 离子化合物;(2)氨气和一氧化氮发生归中反应生成氮气:4NH3+6NO=5N2+6H2O;氧化产物与还原产物的物质的量之比为2:3; (3) 惰性电极电解A和D的混合溶液为盐酸和氯化铵的混液;可生成丁单质为氢气和一种二元化合物三角锥形分子M为NCl3:2HCl+NH4Cl
;D是氯化铵属于 离子化合物;(2)氨气和一氧化氮发生归中反应生成氮气:4NH3+6NO=5N2+6H2O;氧化产物与还原产物的物质的量之比为2:3; (3) 惰性电极电解A和D的混合溶液为盐酸和氯化铵的混液;可生成丁单质为氢气和一种二元化合物三角锥形分子M为NCl3:2HCl+NH4Cl![]() NCl3+3H2↑在碱性溶液中NCl3与NaClO2(亚氯酸钠)按物质的量之比1∶6恰好反应可生成化合物氨气和ClO2气体,该反应的离子方程式为NCl3+3H2O+ClO2— = ClO2↑+3 Cl-+3OH-+3NH3↑(4)氯化铵分解为氨气、氯化钙、水;2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O;(6)Fe、FeO、Fe3O4的混合物二等分,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解所得溶液中加入KSCN溶液,溶液不变红,证明所得的溶液中不含有三价铁离子,有因为A为HCl,故溶质只为FeCl2。物质的量=(1mol/L×0.1L)/2=0.05mol。另一份混合物加入1 mol/ L 的H(HNO3)溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,证明不含三价铁离子,溶质只为Fe(NO3)2根据质量守恒,Fe元素物质的量不变,故n(FeCl2)=n(Fe(NO3)2)=0.05mol。故加入HNO3的体积为100ml。
NCl3+3H2↑在碱性溶液中NCl3与NaClO2(亚氯酸钠)按物质的量之比1∶6恰好反应可生成化合物氨气和ClO2气体,该反应的离子方程式为NCl3+3H2O+ClO2— = ClO2↑+3 Cl-+3OH-+3NH3↑(4)氯化铵分解为氨气、氯化钙、水;2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O;(6)Fe、FeO、Fe3O4的混合物二等分,其中一份加入1mol/L的A溶液100 mL,恰好使混合物全部溶解所得溶液中加入KSCN溶液,溶液不变红,证明所得的溶液中不含有三价铁离子,有因为A为HCl,故溶质只为FeCl2。物质的量=(1mol/L×0.1L)/2=0.05mol。另一份混合物加入1 mol/ L 的H(HNO3)溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也不变红,证明不含三价铁离子,溶质只为Fe(NO3)2根据质量守恒,Fe元素物质的量不变,故n(FeCl2)=n(Fe(NO3)2)=0.05mol。故加入HNO3的体积为100ml。
考点:物质推断、方程式的书写;守恒的计算。


科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
碱 | 酸 | 盐 | 酸性氧化物 | |
A | 纯碱 | 硝酸 | 烧碱 | 二氧化硫 |
B | 苛性钠 | 硫酸 | 胆矾 | 氧化铜 |
C | 烧碱 | 醋酸 | 纯碱 | 三氧化硫 |
D | 氢氧化钡 | 碳酸 | 小苏打 | 水 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 mol CO2和3 molH2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如下图。请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,T温度下,测得CO2和CH3OH(g)的浓度随时间变化如下图。请回答下列问题:
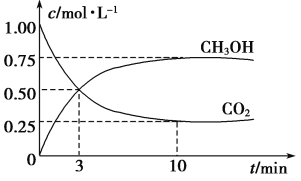
(1) 达平衡时,氢气的平衡浓度为C(H2)= 。
(2) 能够说明该反应已达到平衡的是 (填字母序号,下同)。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3 mol H2的同时生成1 mol CH3OH
(3)下列措施中能使平衡混合物中![]() 增大的是______________。
增大的是______________。
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.降低温度
(4) 求此温度(T)下该反应的平衡常数K = 。若开始时向该1 L密闭容器中充入1 mol CO2,2molH2,1.5mol CH3OH和1 mol H2O(g),则反应向 (填“正”或“逆”)反应方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是( )
A. pH=7的溶液
B. c (H+)=1.0×10-7mol/L的溶液
C. c (H+)="c" (OH-)
D. pH=3的酸与pH=11碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔬菜、水果中富含纤维素,纤维素被食入人体后的作用是
A. 为人体内的化学反应提供原料
B. 为维持人体生命活动提供能量
C. 加强胃肠蠕动,具有通便功能
D. 人体中没有水解纤维素的酶,所以纤维素在人体中没有任何作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+3。回答下列问题:
(1)Y元素简单离子的结构示意图为 。
(2) Y与Z相比,非金属性强的是 (写元素符号)。下列事实能证明这一结论的是 。
A.常温下Y的单质呈气态,而Z的单质呈固态。
B.气态氢化物的稳定性Y比Z强。
C.Y与Z形成的化合物中,Z的化合价呈正价。
(3)Z在元素周期表中的位置是 。Z的最高价氧化物与Z同主族的单质A能发生置换反应,这个反应在工业上是获得Z的一步重要反应。写出该步反应的化学方程式,并标出电子转移的方向与数目 。
(4)向WY3溶液中加入足量的NaOH溶液,反应的离子方程式为 。
(5)ZX2中存在的化学键为 (填“离子键”或“共价键”),它的用途很广泛,请写出它的一个用途 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下的气体672mL,将盛有该气体的容器倒扣在水中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入氧气的体积是( )
A. 168mL B. 224mL C. 504mL D. 336mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应∶2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时,生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com