
| A. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全灭活该病毒感染性,其消毒原理和漂白粉消毒饮用水相同 | |
| B. | 2015年初公益调查《柴静雾霾调查:穹顶之下》发布,引起社会强烈反响.雾霾中PM2.5属于胶体 | |
| C. | 分光光度计可以用来测定某些化学反应的反应速率 | |
| D. | 汽油、煤油、植物油都是油,但它们的主要成分不相同 |
分析 A.高锰酸钾溶液和双氧水、漂白粉均具有强氧化性;
B.PM2.5很多是1微米到2.5微米之间的,大于胶体粒子的大小;
C.对于有些有颜色的反应物(或生成物),随着反应的进行,溶液的颜色为不断变化,可用用于比色分析的分光光度计测定反应速率;
D.汽油、煤油、植物油的成分不同.
解答 解:A.高锰酸钾溶液和双氧水、漂白粉均具有强氧化性,可以将病毒氧化而达到消毒的目的,故A正确;
B.胶体一般认为是1微米以下的,PM2.5很多是1微米到2.5微米之间的,另外雾霾中可能吸收水汽聚集成更大颗粒,故B错误;
C.对于有些有颜色的反应物(或生成物),随着反应的进行,溶液的颜色为不断变化,可用用于比色分析的分光光度计测定反应速率,故C正确;
D.汽油、煤油是烃类的混合物,植物油是酯类,成分不同,故D正确.
故选B.
点评 本题考查了消毒剂、PM2.5、分光光度计及油的分类等,明确汽油、煤油、植物油的区别是解题的关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 铝能与NaCl直接发生反应而被氧化为氧化铝 | |
| B. | 长期存放的NaCl与水反应,溶液不再呈中性,可与铝发生反应 | |
| C. | 铝与其中的杂质、NaCl溶液形成原电池,铝被氧化 | |
| D. | 铝与其中的杂质、NaCl溶液形成原电池,铝被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ρ}{400}$mol•L-1 | B. | $\frac{20}{ρ}$mol•L-1 | C. | $\frac{50ρ}{41}$mol•L-1 | D. | $\frac{25ρ}{41}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用露天焚烧方法处理塑料废弃物 | |
| B. | 利用高纯单质硅制成太阳能电池 | |
| C. | 利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料代替聚乙烯塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
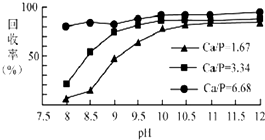 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
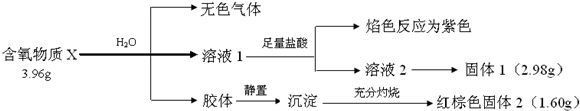
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
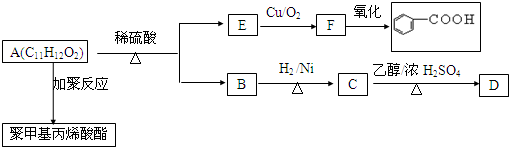
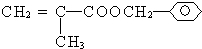 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 都能与NaOH溶液反应,每mol消耗NaOH的物质的量之比为1:1 | |
| B. | 都能与溴水反应,每mol消耗Br2的物质的量之比为3:2 | |
| C. | 都能与H2发生加成反应,每mol消耗H2的物质的量之比为4:7 | |
| D. | 都能与O2发生氧化反应,每mol消耗O2的物质的量之比为13:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
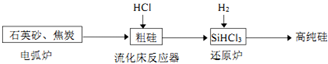
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com