
| 1.0mol/L |
| 2 |


科目:高中化学 来源: 题型:
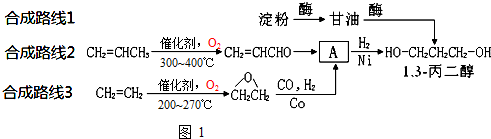
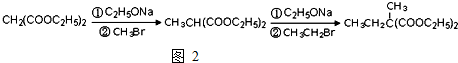
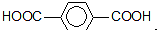 为原料可以合成聚酯PTT,写出其化学方程式
为原料可以合成聚酯PTT,写出其化学方程式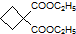 ,再转化为
,再转化为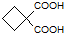 .
.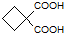 的同分异构体不可能属于
的同分异构体不可能属于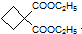 ,必须先合成哪些物质?(用合成该物质的化学方程式回答)
,必须先合成哪些物质?(用合成该物质的化学方程式回答)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、核素就是同位素 |
| B、元素的金属性强弱与元素失去电子数的多少成正比 |
| C、含有离子键的化合物一定是离子化合物 |
| D、含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
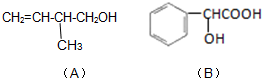 已知有机化合物A和B的结构简式分别为
已知有机化合物A和B的结构简式分别为查看答案和解析>>
科目:高中化学 来源: 题型:
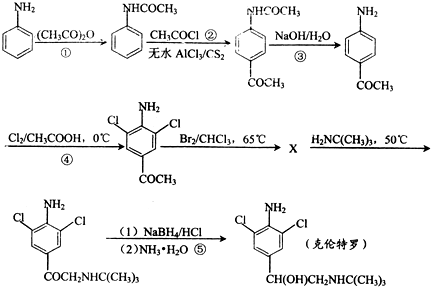
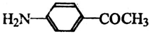 ) 的同分异构体有多种,请写出符合以下条件的其中任意一种
) 的同分异构体有多种,请写出符合以下条件的其中任意一种查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
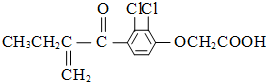
| A、该有机物能发生银镜反应 |
| B、分子中有4个碳碳双键 |
| C、既能发生还原反应,又能发生氧化反应 |
| D、1 mol 该物质最多跟6 mol氢气发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com