
ʵ�����ﳣ��Ũ������������̷�Ӧ����ȡ��������������Ӧ�Ļ�ѧ����ʽΪ��
MnO2��4HCl(Ũ)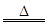 MnCl2��Cl2����2H2O
MnCl2��Cl2����2H2O
��1����Ӧ���У���������________�����ϼ����ߵ�Ԫ����________��
��2��ȡһ�������Ũ������MnO2������Ӧ�������������ڱ�״���µ����Ϊ1.12 L(����Cl2���ܽ�)����μӷ�Ӧ��HCl�����ʵ�����________����Ӧ�б�������HCl��������________��(д����Ҫ�������)

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1�����Ϸ�����(��Ҫ�ɷ�V2O5)��ϡ���ᡢ���������Һ��ϣ���ַ�Ӧ��������Һ�����ԣ���VO2����K����SO42-�ȡ�д���÷�Ӧ�Ļ�ѧ����ʽ_________________________________��
��2��������������Һ�м���KClO3��Һ����ַ�Ӧ����Һ����������VO2+��Cl����д������ƽ�÷�Ӧ�����ӷ���ʽ�����������ת�Ƶ���Ŀ�ͷ���______________________��
��3����20.00 mL��0.1 mol��L��1 VO2+��Һ�У�����0.195 gп�ۣ�ǡ����ɷ�Ӧ����ԭ���������______________________________________________________________��
a��V b��V2�� c��VO2+ d��VO2��
��4����֪V2O5�ܺ����ᷴӦ����������VO2��������дһ�����ӷ�Ӧ����ʽ��˵����ԭ�ԣ�SO32-��Cl����VO2��__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij̽��С�齫һ�����ӷ���������õ���Cu��Al��Fe������Au��Pt�Ƚ����Ļ�������������Ʊ�����ͭ�������ˮ�Ȼ����ķ�����
��֪��Cu2+ + 4NH3��H2O��[Cu(NH3)4]2+ + 4H2O
��ش��������⣺
��1�������Cu���ᷴӦ�����ӷ���ʽΪ ��
��2������ڼ�H2O2�������� ������2Ϊ(�ѧʽ) ��
��3������ݲ���ֱ�Ӽ�����ˮ�������� ��
��4������Һ1��Cu2+��Ũ��Ϊ0��02mol��L-1����������ͭ��ʼ����ʱ��pH =
(��֪��Ksp[Cu(OH)2]��2��0��10-20)��
��5����֪��2Cu2+��4I-�� 2CuI����I2 I2��2S2O32-�� 2I-��S4O62-
ijͬѧΪ�˲ⶨCuSO4��5H2O��Ʒ�����������ɰ����·�����ȡ3��00g��Ʒ����ˮ�ܽ����������KI��Һ����ַ�Ӧ����ˡ�ϴ�ӣ�����Һϡ����250mL��ȡ50mL���������Һ��ָʾ������0��080 mol��L-1 Na2S2O3����Һ�ζ����ﵽ�ζ��յ�������� ��
�Ĵ�ƽ��ʵ���ȥNa2S2O3����Һ�������£�
| ʵ����� | 1 | 2 | 3 | 4 |
| ����Na2S2O3����Һ(mL) | 25��00 | 25��02 | 26��20 | 24��98 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ�ڻ�������������ʮ����Ҫ�����á������������͵绯ѧ���ⷨ����������ˮ�������ε���Ⱦ��
��1�������������У�H2�ܽ�NO3-��ԭΪN2��25��ʱ����Ӧ����l0 min����Һ��pH��7��Ϊl 2��
��N2�ĽṹʽΪ
��������Ӧ�����ӷ���ʽΪ ����ƽ����Ӧ����v(NO3-)Ϊ mol��L-1��min-1��
�ۻ�ԭ�����п������м����NO2-��д��2�ִٽ�NO2-ˮ��ķ��� ��
��2���绯ѧ����NO3-��ԭ������ͼ��ʾ��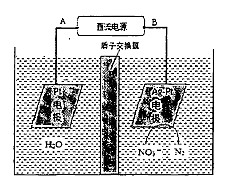
�ٵ�Դ����Ϊ (�A����B��)��������ӦʽΪ��
������������ת����2 mol���ӣ���Ĥ������Һ�������仯��(��m��-��m��)Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ס�����ͬѧ�о�Na2SO3��Һ��FeCl3��Һ��Ӧ�������
| ���� | ���� | ���� |
| I | ��2 mL 1 mol��L-1FeCl3��Һ�м���һ������Na2SO3��Һ | ��Һ���ػ�ɫ��Ϊ���ɫ�� ���������̼�����ζ�������ݳ� |
 SO32- +
SO32- + =
= F e2+ +
F e2+ + +
+

| 1��Fe2+��SO32-��Ӧ����ī��ɫ����״����FeSO3�� 2��ī��ɫ��FeSO3���ɫ��FeCl3��Һ��Ϻ���Һ�ʺ��ɫ�� |
| ���� | ���� | ���� |
| II | �ü�������䲽��I�еĺ��ɫ��Һ | ���֡������ЧӦ�� |
| ���� | ���� | ���� |
| III | ��1 mol?L-1��FeCl3��Һ��ͨ��һ������SO2 | ��Һ�ɻ�ɫ��Ϊ���ɫ |
| IV | �ü�������䲽��III�еĺ��ɫ��Һ | û�г��֡������ЧӦ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������ƣ�NaH2PO2�������ڻ�ѧ��������ͨ����ѧ��Ӧ�����϶Ƽ�������������Ͻ�
��1����ѧ��������Һ�к���Ni2+��H2PO2���������������·������¶�����Ӧ��
�� Ni2+ + H2PO2��+ �� Ni + H2PO3��+
�� 6H2PO2- +2H+ ��2P+4H2PO3-+3H2��
����ƽ��Ӧʽ�١�
��2����Ӧʽ���л�ԭ���� ������ԭԪ���� ��
��3����Ӧ���У�������1 mol H2PO3-����Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ ��
��4���Ӷ�����ѧ������Ӧ������������1mol Ni��1mol P��ͬʱ�� mol H2PO3�����ɡ�
��5��������и�С���еĻ�ѧ��Ӧ����ʽ���������O2��Ӧ����������ϸ��ӣ�����ͨ�������K2O�����������K2O2�����г�������ͳ�������ȡ�Ҫ�Ʊ����������ͨ������һ�����ü������ԭ��Ӧ�Ĺ�����������λ��������Ρ�д�����л�ѧ��Ӧʽ��
������������Ʒ�Ӧ
�ڼػ�ԭ����ػ�������һ�ֵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������ˮ��Һ�׳�˫��ˮ���е��ˮ�ߣ����⡢�ȼ��ؽ���������Ⱦ�������ֽ⡣
��1��ij�Լ������Ƶ�7%~8%��˫��ˮ��������Ũ����30%����Һ�����˷�����
����д��ţ���
a����ѹ���� �� b����ѹ���� c��������ʯ�ҳ�ѹ���� ���� d����ѹ����
��2������õ���˫��ˮ����Ԫ�صĺ���Ϊ90%�����������Ĵ���Ϊ ��������֪�������ڿ�����ȼ������ˮ����������������ڿ�����ȼ��Ҳ��������H2O2����������¶��ֽ��ˡ�Ϊ����֤�����ڿ�����ȼ�յIJ������Ƿ���H2O2��ij����С��ͬѧ��Ƶ�ʵ��װ�ü�ͼ-1��
��3����ͬѧ�����ͼ-2�Ģ٣�����ѡȡ���ͼ��1�����е�װ�ã����е��� ����д��ţ���
��4������ͬѧ�����Ը��������Һ����H2O2�Ĵ��ڣ���ɸ÷�Ӧ�����ӷ���ʽ��
�� + �� Mn2+ + H2O
��ͬѧ���ҵļ��鷽����������ɣ���п����ϡ����ķ�Ӧ�в���������H2S�Ȼ�ԭ�����壬Ҳ��ʹ���Ը��������Һ��ɫ�������ͬѧ��ʵ�鷽������Ľ����飺 ��
��5����̼���ƣ�2Na2CO3?3H2O2���׳ƹ���˫��ˮ�����ֽ⣬��ֽⷴӦ�Ļ�ѧ����ʽ�ɱ�ʾΪ��2 (2Na2CO3?3H2O2) �� 4Na2CO3 + 6H2O + 3O2��
ȡһ�����Ĺ�̼�������ܱ�������ʹ����ȫ�ֽ⣬�����������12.0g����ȴ�����º������ò����м�ˮ���Ƴ�10.6% ��Na2CO3��Һ�����ˮ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������ԭ��Ӧ�У�����ת�Ƶı�ʾ����ͨ���õ����ŷ���˫���ŷ����Է��������ֱ�ʾ����������������ա�
��1���굥���ţ�4�֣�
KIO3��6HI��KI��3I2��3H2O���������뻹ԭ�������ʵ���֮�ȣ� ��
��2����ƽ��ѧ����ʽ����˫���ţ�5�֣�
Fe + HNO3(ϡ)�� Fe(NO3)2+ NO��+ H2O��Ӧ�У��������뻹ԭ�������ʵ���֮�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����֪�����������������Һ�У���������ɫ���壬����Һ���Ϻ�ɫ��ȥ�� ����һ��������ԭ��Ӧ����ϵ�й���KCl��Cl2��H2SO4��H2O��KMnO4��MnSO4��K2SO4�������ʣ�
�ٸ÷�Ӧ�У����ϼ����ߵķ�Ӧ����________�����ϼ�û�з����仯�ķ�Ӧ����_______��
��д��һ�����������������ʵ�������ԭ��Ӧ����ʽ(������ƽ) ___________��
��������Ӧ�У���������________��1 mol�������ڷ�Ӧ��________(��õ�����ʧȥ��)________mol���ӡ�
������ڷ�Ӧ�����Һ�м���NaBiO3����Һ�ֱ��Ϻ�ɫ��˵��NaBiO3��һ�����ʣ�___________________________________________________________________��
��2��ij��Ӧ��ϵ�е������У�NaOH��Au2O3��Na2S4O6��Na2S2O3��Au2O��H2O��
�ٽ��������뻹ԭ���������пո��У����������ת�Ƶķ������Ŀ��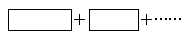
��Ӧ�У�����ԭ��Ԫ����________������������______________��
�ڷ�֯��ҵ�г���������Ư����Na2S2O3����ΪƯ�ײ�ƥ�ġ����ȼ�����Na2S2O3��Cl2��Ӧ�IJ�����H2SO4��NaCl��HCl����ԭ���������������ʵ���֮��Ϊ________��
��3��һ�������£����ˮ�м���CH3OH����HNO3��ԭ��N2�����÷�Ӧ����3.2 g CH3OHת��0.6 mol���ӣ�����������Ϊ���ѧʽ�������������뻹ԭ��������ʵ���֮����________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com