
使同体积的FeSO4溶液和Fe2(SO4)3溶液中的Fe2+和Fe3+完全沉淀,分别用去同体积同浓度的烧碱溶液,则FeSO4溶液和Fe2(SO4)3溶液的物质的量浓度之比是
[ ]
A.1:1 B.1:2 C.3:1 D.3:2
科目:高中化学 来源:贵州省遵义四中2010-2011学年高二上学期期末考试化学文科试题 题型:013
|
使相同体积的Fe2(SO4)3溶液和FeSO4溶液中Fe3+和Fe2+完全沉淀,分别用去同体积、同浓度的烧碱溶液,则Fe2(SO4)3溶液和FeSO4溶液的物质的量浓度之比是 | |
| [ ] | |
A. |
1∶1 |
B. |
1∶3 |
C. |
3∶1 |
D. |
3∶2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省开封市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
硫酸厂用煅烧黄铁矿(FeS2)制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2制备绿矾。
(一)SO2和O2反应制取的反应原理为:2SO2+O2 2SO3,在一密闭容器中一定时间内达到平衡。
2SO3,在一密闭容器中一定时间内达到平衡。
(1)该反应的平衡常数表达式为______。
(2)该反应达到平衡状态的标志是______。
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
(二)某科研单位利用原电池原理,用SO2和O2制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。

(3)B电极的电极反应式为______;溶液中H+的移动方向由______极到______极;电池总反应式为______。
(三)利用烧渣制绿矾的过程如下
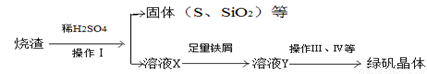
测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL。溶液。
b.量取25 ml。待测液于锥形瓶中。
c.用硫酸酸化的0. 01 mol/LKMnO4 溶液滴定至终点,消耗KMnO4溶液体积40 mL。根据上述步骤同答下列问题。
(4)滴定时发生反应的离子方程式为(完成并配平离子反应方程式)。

(5)用硫酸酸化的KMnO4滴定终点的标志是
(6)计算上述产品中的FeSO4.7H2O质量分数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com