
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是( )
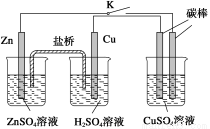
A.铜棒为正极,其电极反应式为2H++2e-→H2↑
B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出
C.反应中消耗锌的质量为13 g
D.导线中通过的电子的物质的量为0.2 mol
科目:高中化学 来源:2017届河北省高三上学期第一次月考化学试卷(解析版) 题型:选择题
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
编号 | X | Y | Z |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上第一次月考化学试卷(解析版) 题型:实验题
有关混 合物分离与提纯的方法广泛用于实验研究和生产。
合物分离与提纯的方法广泛用于实验研究和生产。

根据上图装置回答下列问题:
(1)若用装置A分离CCl4和溴苯的混合物(已知CCl4和溴苯互溶,沸点分别为76.75℃和156.2℃),在实验时冷却水从冷凝管的 (填“a”或“b”)端通入;温度计读数为80℃时,锥形瓶中收集到的物质是 。
(2)装置B中仪器①的名称是 ,用装置B分离混合物时,为使液体顺利流下,应进行的操作是 。
(3)粗盐中含有少量泥沙、MgCl2、CaCl2及硫酸盐,将粗盐溶解后,先用装置C将泥沙除去,除去泥沙后还需进一步提纯,粗盐提纯步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液PH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是 。
A.⑤②③①⑥④⑦ B.⑤①②③⑥④⑦ C.②①③④⑥⑦ D.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上第一次月考化学试卷(解析版) 题型:选择题
下列实验操作正确的是( )
A. 检查容量瓶是否漏水
B. 给液体加热
C. 称量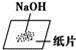
D. 过滤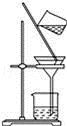
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上10月月考化学试卷(解析版) 题型:填空题
在25 ℃时,用石墨电极电解2.0 L 0.5 mol·L-1CuSO4溶液 。5 min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题:
。5 min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题:
(1)发生氧化反应的是 极,电极反应式为 。
(2)若电解后溶液的体积不变,则电解后溶液的H+浓度为 。
(3)若将溶液恢复到与电解前一样,则需加入 mol的 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为Fe(OH)3-3e-+5OH-=FeO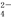 +4H2O
+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.工业上电解熔融Al2O3制备金属铝
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.金属锌与稀硫酸反应制取氢气,粗锌比纯锌反应速率快
D.电解MgCl2饱和溶液,可制得金属镁
查看答案和解析>>
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:填空题
二氧化碳的回收利用是环保领域研究热点。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示。总反应的化学方程式为 。

(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O。已知298K和101KPa条件下:
CH3OH+H2O。已知298K和101KPa条件下:
CO2(g)+3H2(g) CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热△H=___________________。
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为
2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) △H<0
CH2= CH2(g) +4H2O(g) △H<0
在恒容密闭容器中充入2 mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比 的关系如右图所示。
的关系如右图所示。
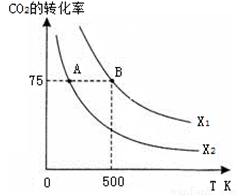
①平衡常数KA KB
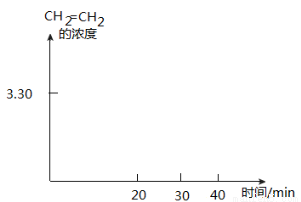
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2 B.通入一定量CH2=CH2
C.加入合适催化剂 D.缩小容器体积
画出CH2=CH2的浓度随反应时间的变化曲线。
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) △H< 0
CH2= CH2(g) +4H2O(g) △H< 0
B.2CO2(g) + 6H2(g)  CH3OCH3(g)+3H2O(g) △H< 0
CH3OCH3(g)+3H2O(g) △H< 0

上图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2。常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,则0.5mol·L-1的Na2CO3溶液的pH等于 (不考虑第二步水解和H2O的电离)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上第一次月考化学试卷(解析版) 题型:选择题
在恒温恒容的密闭容器中,发生反应:3A(g)+B(g)  xC(g)Ⅰ.将3mol A和2mol B,在一定条件下反应,达到平衡时C的体积分数为a;Ⅱ.若A、B、C起始投入的物质的量分别为n(A)、n(B)、n(C),在相同条件下达到平衡时,C的体积分数也为A.下列有关叙述正确的是
xC(g)Ⅰ.将3mol A和2mol B,在一定条件下反应,达到平衡时C的体积分数为a;Ⅱ.若A、B、C起始投入的物质的量分别为n(A)、n(B)、n(C),在相同条件下达到平衡时,C的体积分数也为A.下列有关叙述正确的是
A.若Ⅰ达到平衡时,A、B、C各增加1mol,则B的转化率一定增大
B.若向平衡Ⅰ中再加入6mol A,4mol B.测得C的体积分数大于a,可断定x>4
C.若x=2,则体系Ⅱ起始物质的量应满足:3n(B)=n(A)-3
D.若体系Ⅱ起始物质的量满足3n(c)+4nA=12nB,则可推断:x=4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com