
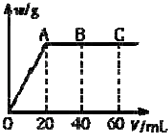
 有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).
有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).分析 (1)由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,故根据方程式计算硫酸的物质的量;由图可知,PH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知n(H+)=n(OH-),据此计算原溶液中含有的n(H+),进而计算HCl电离产生的氢离子物质的量,再根据c=$\frac{n}{V}$计算硫酸、盐酸的物质的量浓度;
(2)加入Ba(OH)2体积为20mL时,而盐酸未反应,计算混合后氢离子的浓度,根据pH=-lgc(H+);根据原溶液中含有的n(H+)=0.003mol结合加入Ba(OH)2体积为40mL,计算混合后氢离子的浓度,根据pH=-lgc(H+)计算.
解答 解:由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+H2O,20mL~60mLBa(OH)2溶液发生发生H++OH-═H2O,
(1)由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,设硫酸的物质的量为x,则:
H2SO4+Ba(OH)2═BaSO4↓+H2O
1 1
x 0.02L×0.025mol•L-1
故x=0.02L×0.025mol•L-1=0.0005mol,
硫酸的物质的量浓度为$\frac{0.0005mol}{0.02L}$=0.025mol•L-1,
由图可知,PH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知原溶液中含有的n(H+)=n(OH-)=2×0.06L×0.025mol•L-1=0.003mol,故n(HCl)=0.003mol-0.0005mol×2=0.002mol,
故原溶液中HCl的物质的量浓度=$\frac{0.002mol}{0.02L}$=0.1mol/L,
答:原混合液中硫酸的物质的量浓度为0.025mol•L-1,盐酸的物质的量浓度为0.1mol•L-1;
(2)由图可知A点,加入Ba(OH)2体积为20mL时,硫酸完全反应,氢离子的浓度为$\frac{0.1mol/L×0.02l}{0.02L+0.02L}$=0.05mol/L,则pH=-lg0.05=1.3,
加入Ba(OH)2体积为40mL时,氢离子的浓度为$\frac{0.003mol-2×0.04L×0.025mol/L}{0.02L+0.04L}$=$\frac{1}{60}$mol/L,pH=-lg$\frac{1}{60}$≈1.8,
答:A点溶液的pH为1.3,B点时溶液的pH为1.8.
点评 本题考查了有关方程式的计算、溶液pH的计算,明确图象中对应的化学反应是解答本题的关键,注意图象中A点硫酸恰好完全反应为难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 18% | C. | 20% | D. | 40% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在反应2 H2S+SO2→3 S+2 H2O中被氧化与被还原的硫原子的质量 | |
| B. | 相同温度下,0.2 mol•L-1 CH3COOH溶液与0.1 mol•L-1 CH3COOH溶液中的c(H+) | |
| C. | 在密闭容器中,N2+3H2?2NH3达平衡时的c(NH3)与c(N2) | |
| D. | Na2CO3晶体中Na+与CO32-离子个数比 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:
水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂.实验室制备水杨酸甲酯装置示意图和有关数据如下:| 相对分子 质量 | 沸点/℃: | 在水中的溶解性 | |
| 甲醇 | 32 | 64.7 | 与水以任何比例相溶 |
| 水杨酸 | 138 | 211 | 0.22g/100ml |
| 水杨酸甲酯 | 152 | 222 | 0.07g/100ml |
 +CH3OH$\stackrel{H+}{?}$
+CH3OH$\stackrel{H+}{?}$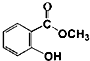 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:推断题
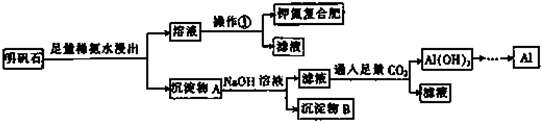
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
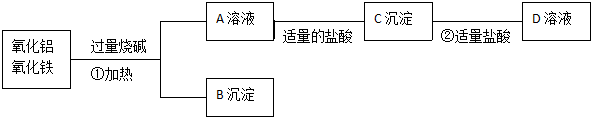
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | W 的最高价氧化物的水化物酸性比Z的强 | |
| B. | 原子半径:Z>W,离子半径:Z<W | |
| C. | Y的气态氢化物可与W的气态氢化物反应生成一种离子化合物 | |
| D. | X元素形成的化合物种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com