
【题目】有下列物质:
①硫酸 ②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜 ⑦醋酸 ⑧氯化氢 ⑨蔗糖 ⑩氨气 CO2 NaHCO3 A l(OH)3 NaOH
(1)属于非电解质的为____(填序号,下同),属于弱电解质的为___,能导电的是___。
(2)写出下列反应的离子方程式
①NaHCO3溶于醋酸:______________________。
②过量CO2与NaOH溶液反应:______________。
③Cl2通入NaOH溶液中:___________________。
【答案】⑤⑨⑩ ⑦ ②⑥ HCO![]() +CH3COOH===CH3COO-+CO2↑+H2O CO2+OH-===HCO
+CH3COOH===CH3COO-+CO2↑+H2O CO2+OH-===HCO![]() Cl2+2OH-===Cl-+ClO-+H2O
Cl2+2OH-===Cl-+ClO-+H2O
【解析】
(1)根据物质分类来判断物质的类别;
(2)②过量的CO2生成碳酸氢盐;
(1)属于非电解质的化合物包括大多数有机物、非金属氧化物、某些非金属氢化物等。⑤酒精,乙醇属于有机物;⑨蔗糖,属于有机物;⑩氨气,非金属的氢化物,在水溶液中不电离;CO2,非金属氧化物;属于非电解质的包括⑤⑨⑩;
弱电解质包括弱酸、弱碱、两性氢氧化物、水等;⑦醋酸,弱酸;Al(OH)3,属于两性氢氧化物。属于弱电解质的包括⑦;
能导电的物质有自由移动的电子,如金属单质,或有自由移动的离子,如电解质溶液。②盐酸,HCl的水溶液,有自由移动的H+和Cl-,可以导电;⑥铜,金属单质,有自由移动的电子能够导电。能够导电的包括②⑥;
(2)①醋酸是弱酸不能拆成离子形式,HCO3-是弱酸的酸式根离子也不能拆,生成的碳酸不稳定,分解为CO2和水,离子方程式为HCO![]() +CH3COOH=CH3COO-+CO2↑+H2O;
+CH3COOH=CH3COO-+CO2↑+H2O;
②过量的CO2生成酸式盐,NaOH为强碱,可以拆开,离子方程式为:CO2+OH-=HCO3-;
③氯气与氢氧化钠反应,为歧化反应生成氯化钠和次氯酸钠,产物均为溶于水的强电解质,可以拆成离子形式;离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中________(填元素符号)的非金属性最强;________(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:___________________________________________________。
(2)表中元素③的原子结构示意图是____________。
(3)表中元素⑥、⑦的氢化物的稳定性顺序为
(4)表中元素最高价氧化物对应水化物酸性最强的是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,反应X(g)![]() 4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是
4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是
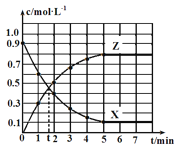
A. 2 min内,X的平均反应速率为0.25 mol·L-1·min-1
B. 第t min时,该反应达到平衡状态
C. 第5 min后,X的生成速率与Z的生成速率相等且保持不变
D. 5 min内,反应放出的热量为1.6Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一氢气和氯气的混合气体,经点燃并充分燃烧,然后将气体冷却,并用 200mL 4.00mol·L-1 的 NaOH 溶液恰好完全吸收,测得溶液中含有 ClO-的物质的量为 0.1mol。
(1)所得溶液中 Cl-的物质的量为_________mol;
(2)原混合气体中氢气和氯气的物质的量比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:
(1)分别写出三只烧杯中形成分散系的名称:
A________,B________,C________。
(2)写出C中形成分散系的化学方程式:_____________________________________。
(3)若不用化学试剂鉴别,写出鉴别B、C分散系的两种简单方法:
①______________________________________________________,
②________________________________________________________。
(4)向C中逐滴加入稀H2SO4,现象为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式错误的是
A. 甲烷的电子式:![]()
B. 碳原子的L层电子轨道表示式:![]()
C. 硫离子的核外电子排布式:1s22s22p63s23p6
D. 碳-12原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A由两种元素组成,为探究其组成和性质,设计并完成如下实验:
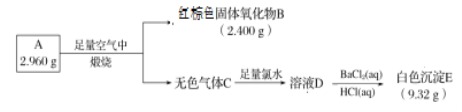
(1) A的化学式为______。
(2) 用化学方程式表达气体C与氯水反应生成D的过程:________。
(3) B溶于盐酸后生成的物质F可用于净水,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去括号内的杂质,所选用的试剂或方法不正确的是
A. Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B. NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C. Na2O2粉末(Na2O),将混合物在氧气中加热
D. Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe 四种金属元素组成,回答下列问题:
(1)基态 Fe原子有________个未成对电子,Fe3+的价电子排布式为________。
(2)新制的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙醛分子中含有的σ键与π键的比值为_____。乙醛中碳原子的杂化轨道类型为____,配合物[Cu(NH3)4](OH)2中含有的化学键类型有_____。
(3)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有____个铜原子;金属铜采取如图甲所示堆积方式,可称为_____堆积。。
(4)CaCl2熔点高于AlCl3的原因________。
(5)CaF2晶胞如图乙所示,已知:氟化钙晶体密度为ρg·cm-3 , NA代表阿伏加德罗常数的值。氟化钙晶体中Ca2+和F-之间最近核间距(d)为________cm(只要求列出计算式即可)。
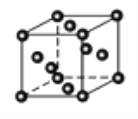 (甲)
(甲) 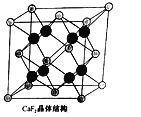 (乙)
(乙)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com