
| A. | 单质均有颜色,随原子序数递增颜色加深 | |
| B. | HX随原子序数递增稳定性逐渐减弱 | |
| C. | 单质(除F2)均能与水反应形成HX和HXO,HXO的结构式为:H-X-O | |
| D. | HX中除HF分子间存在氢键,其余HX分子均不存在氢键 |
分析 A.卤素单质均有颜色,随原子序数的增大,由浅黄绿色→黄绿色→红棕色→紫色变化;
B.非金属性越强,对应氢化物越稳定;
C.F2与水反应生成HF和氧气,其它卤素单质与水反应生成HX和HXO,X只能形成1个共键单键;
D.F的非金属性强,吸引电子的能力强.
解答 解:A.随原子序数的增大,由浅黄绿色→黄绿色→红棕色→紫色变化,单质均有颜色,随原子序数递增颜色加深,故A正确;
B.非金属性越强,对应氢化物越稳定,则HX随原子序数递增稳定性逐渐减弱,故B正确;
C.F2与水反应生成HF和氧气,其它卤素单质与水反应生成HX和HXO,X只能形成1个共键单键,可知HXO的结构式为:H-O-X,故C错误;
D.F的非金属性强,吸引电子的能力强,则HX中除HF分子间存在氢键,其余HX分子均不存在氢键,故D正确;
故选C.
点评 本题考查卤素单质的性质,为高频考点,把握卤素单质的性质、性质变化规律为解答的关键,侧重分析与应用能力的考查,注意规律性及特性的应用,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | NH3分子结构式: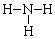 | B. | 氚原子符号:21H | ||
| C. | Mg2+离子的电子式:Mg: | D. | C2H4分子比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,发生放热反应 | |
| B. | HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ba(OH)2的反应热△H=2×(-57.3)KJ/mol | |
| C. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作 | 现象 |
| A | 验证BaSO3难溶于水 | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 |
| B | 验证非金属性:Br>I | 将溴水滴加到淀粉KI溶液中 | 溶液变蓝 |
| C | 验证SO2的漂白性 | 将SO2通入氯水中 | 氯水褪色 |
| D | 验证某化合物是钠盐 | 将该化合物在酒精灯上灼烧 | 焰色为黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:戊<丁<丙 | |
| B. | 金属性:甲>丙 | |
| C. | 最高价氧化物水化物碱性:丙>丁>戊 | |
| D. | 最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,lmoI丙烷共用电子对数为10 NA | |
| B. | 0.5 moI甲烷和0.5 mol乙酸完全燃烧消耗的O2分子数都为0.2NA | |
| C. | 标准状况下,1L辛烷充分燃烧后生成气态产物的分子数为$\frac{8}{22.4}$NA | |
| D. | 1 mol甲醇与足量钠反应,转移电子数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
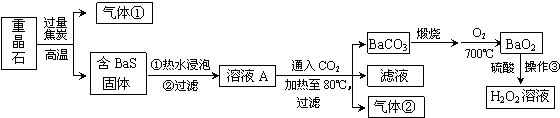
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、OH-、CO32- | |
| B. | 在含等物质的量的FeBr2、FeI2溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含等物质的量的KOH、Ba(OH)2溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 | |
| D. | 在含等物质的量的Fe3+、Cu2+、H+溶液中加入锌粉:Fe3+、Cu2+、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com