
分析 氢键结合的通式,可用X-H…Y表示.式中X和Y代表F,O,N等电负性大而原子半径较小的非金属原子.X和Y可以是两种相同的元素,也可以是两种不同的元素.
解答 解:①由于HClO 4的结构图 所示,分子中含有OH键,所以分子中有几乎裸露的质子存在,而分子中的每个O原子都有孤对电子存在,所以分子中的H和O都有形成氢键的能力.这四个键呈四面体地分布,而与H结合的O原子周围的两个共价键也不能直线排布,只能V形分布,这样,H与周围的O原子相距较远,因此这个H就难以跟周围的O原子形成分子内氢键.故HClO 4形成的是分子间氢键.
所示,分子中含有OH键,所以分子中有几乎裸露的质子存在,而分子中的每个O原子都有孤对电子存在,所以分子中的H和O都有形成氢键的能力.这四个键呈四面体地分布,而与H结合的O原子周围的两个共价键也不能直线排布,只能V形分布,这样,H与周围的O原子相距较远,因此这个H就难以跟周围的O原子形成分子内氢键.故HClO 4形成的是分子间氢键.
②同理,可知H 2SO 4的分子结构如图 :四个氧原子位于四面体的四个顶角.所以H 2SO 4分子不能形成分子内氢键,只能形成分子间氢键.
:四个氧原子位于四面体的四个顶角.所以H 2SO 4分子不能形成分子内氢键,只能形成分子间氢键.
③H 3PO 4的分子结构为: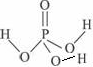 ,故H 3PO 4分子也不能形成分子内氢键,只能形成分子间氢键.
,故H 3PO 4分子也不能形成分子内氢键,只能形成分子间氢键.
④HNO 3的分子结构如图所示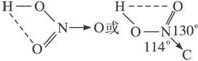 ;由于三个O原子位于平面三角形的三个顶角上,OH键夹角约为一百零几度,所以分子中的H与一个O原子相距较近,且在同一个平面内,因此可跟这个O形成较弱的分子内氢键.
;由于三个O原子位于平面三角形的三个顶角上,OH键夹角约为一百零几度,所以分子中的H与一个O原子相距较近,且在同一个平面内,因此可跟这个O形成较弱的分子内氢键.
⑤HSe键的氢不是几乎裸露的质子,所以不能形成氢键.
⑥H 3PO 2分子的结构如图所示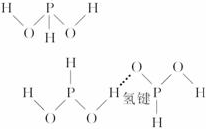 :两个O原子和PH键中的H原子位于三角锥形的三个顶角上,从结构图可知:H 3PO 2分子中OH的H与另一个O相距较远,所以不可能形成分子内氢键,故H 3PO 2分子间可形成氢键,与P结合的H不能形成氢键;
:两个O原子和PH键中的H原子位于三角锥形的三个顶角上,从结构图可知:H 3PO 2分子中OH的H与另一个O相距较远,所以不可能形成分子内氢键,故H 3PO 2分子间可形成氢键,与P结合的H不能形成氢键;
⑦C2H5OH分子含有OH键,分子内只有一个O原子,所以C2H5OH分子只能形成分子间氢键,不能形成分子内氢键;
⑧CH 3COOH的结构如图所示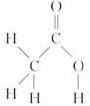 :两个O原子和一个C原子位于平面三角形的三个顶角上,H原子与另一个O原子相距较远,所以难以形成分子内氢键,而可形成分子间氢键.
:两个O原子和一个C原子位于平面三角形的三个顶角上,H原子与另一个O原子相距较远,所以难以形成分子内氢键,而可形成分子间氢键.
⑨H2O2的结构如下图所示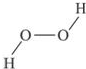 (属于书面展开形结构),每个H原子与另一个O原子相距较远,所以分子内不可能形成氢键,只能形成分子间氢键.
(属于书面展开形结构),每个H原子与另一个O原子相距较远,所以分子内不可能形成氢键,只能形成分子间氢键.
⑩HBrO 3分子的结构为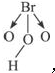 ,三个O原子位于三角锥形的三个顶角上,H原子与另外两个O原子相距较远,所以不可能形成分子内氢键,只能形成分子间氢键.
,三个O原子位于三角锥形的三个顶角上,H原子与另外两个O原子相距较远,所以不可能形成分子内氢键,只能形成分子间氢键.
⑪NaOH是离子化合物,不存在分子,只存在阴、阳离子,所以不可能存在分子间氢键,所以分子间否形成氢键是:①②③④⑥⑦⑧⑨⑩,故答案为:①②③④⑥⑦⑧⑨⑩.
点评 本题考查氢键的形成条件,难度不大.要注意电负性大而原子半径较小的非金属原子与H原子结合才能形成氢键.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
 )
) $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$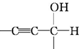
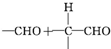 $\stackrel{稀NaOH}{→}$
$\stackrel{稀NaOH}{→}$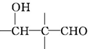
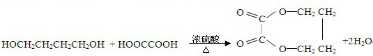 (注明条件).
(注明条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合物:漂白粉、福尔马林、水玻璃 | B. | 化合物:CaCl2、烧碱、HD | ||
| C. | 电解质:明矾、HCl、硫酸钡 | D. | 纯净物:干冰、冰水混合物、红宝石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:Z>Y>X | B. | 单质密度:Y>X>Z | ||
| C. | 离子半径:X2->Z->Y+ | D. | 原子序数:X>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com