
| A、甲∠乙∠丙∠丁 |
| B、丁∠甲∠丙=乙 |
| C、甲=丁∠丙=乙 |
| D、丁∠甲∠乙∠丙 |
| 1 |
| 2 |
| 1 |
| 2 |
| 4g |
| 100g+2.2g |
| 8g |
| 100g+6.2g |
| 8g |
| 100g+6.2g |
| 4g |
| 100g+4g |


科目:高中化学 来源: 题型:
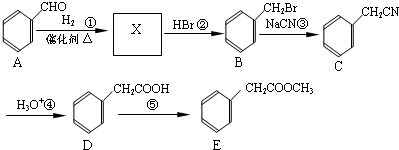
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、植物油可以作为萃取剂分离出碘水中的碘 |
| B、石油的分馏、煤的气化、海水制镁都包括化学变化 |
| C、处理废水时加入明矾作为消毒剂,可以除去水中的杂质 |
| D、乙烯、甲烷、SO2三种无色气体可用溴水鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、②④⑤ | D、②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、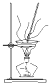 灼烧 |
B、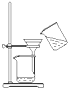 过滤 |
C、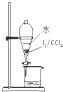 分液 |
D、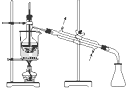 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、Cl-、CO32- |
| B、K+、Na+、NO3-、SO42- |
| C、Mg2+、K+、NO3-、Cl- |
| D、Fe2+、NO3-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加压(体积变小),将使正逆反应速率均加快 |
| B、保持体积不变,加入少许NO2,将使正反应速率减小 |
| C、保持体积不变,加入少许N2O4,再达平衡时,颜色变深 |
| D、保持体积不变,升高温度,再达平衡时,颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com