
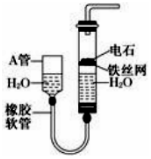
 如图,图中的实验装置可用于制取乙炔.
如图,图中的实验装置可用于制取乙炔.分析 由制备乙炔的实验装置可知,电石与水反应生成乙炔,反应剧烈,可利用食盐水代替水,反应生成的乙炔中混有硫化氢杂质,可利用硫酸铜除去,图中A管可上下移动,调节水的液面高度,控制反应的发生和停止,且乙炔含碳碳三键,易发生加成反应,以此来解答.
解答 解:(1)图中A管的作用是调节水面高度以控制反应的发生和停止,制取乙炔的化学方程式是CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:调节水面高度以控制反应的发生和停止;CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)实验时常滴加饱和食盐水而不直接滴加水,其目的是减缓电石与水的反应速率,为了除去反应后的气体杂质,常选用试剂为硫酸铜溶液或氢氧化钠溶液,
故答案为:减缓电石与水的反应速率;硫酸铜溶液或氢氧化钠溶液;
(3)乙炔含碳碳三键,则乙炔通入溴的CCl4溶液中观察到的现象是溴的CCl4的溶液褪色,因乙炔发生了加成反应,
故答案为:溴的CCl4的溶液褪色;加成.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、实验装置的作用、有机物的性质为解答的关键,侧重分析与实验能力的考查,注意反应速率及混合物分离提纯的应用,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
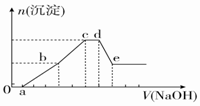 向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )
向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )| A. | 在0~a段加入的NaOH溶液与NH4Cl反应 | |
| B. | 在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3 | |
| C. | c点溶液中溶质只有NaCl | |
| D. | 在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
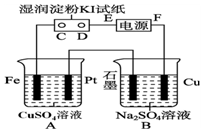 用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 要除去含有 A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2 | |
| B. | 还原性强弱顺序为:A2+>B->Z->X2+ | |
| C. | X2+是 XO4- 的还原产物,B2是 B-的氧化产物 | |
| D. | 在溶液中可能发生反应:XO4-+5 A2++8H+=X2++5A3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杜绝铝制品在生产生活中的应用 | |
| B. | 不能用铝制器皿长期存放酸性或碱性食品 | |
| C. | 不吃或少吃使用了含铝食品添加剂的食物 | |
| D. | 氢氧化铝可用于药物治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2-1s22s22p4 | B. | Ca 3d2 | ||
| C. | Fe 3d54s3 | D. | Si 1s22s22p63s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
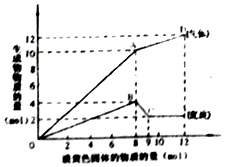 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )| A. | 溶液中一定含有Mg2+、NH4+、Al3+,可能含有Fe2+ | |
| B. | 图中A点产生的气体总质量为230克 | |
| C. | 图中A到D之间会产生有刺激性气味的气体 | |
| D. | 图中B到C之间发生的化学反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
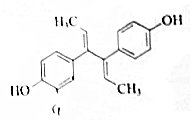 双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )
双烯雌酚是人工合成的雌激素化合物,其结构简式如图,下列说法不正确的是( )| A. | 分子式为C18H18O2,可溶于氯仿或氢氧化钠溶液 | |
| B. | 双烯雌酚既可发生加聚反应,也可以发生缩聚反应 | |
| C. | 其苯环上的二氯代物有7种 | |
| D. | 1 mol双烯雌酚跟H2反应,最多可消耗8mol H2. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com