
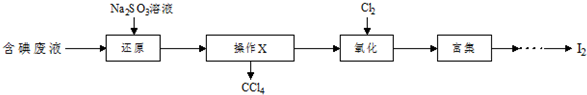
分析 含碘废液含有CCl4、I2、I-等,加入亚硫酸钠溶液还原碘单质为碘离子,分液得到溶液中通入氯气氧化碘离子为碘单质,富集碘元素,加入四氯化碳萃取分液后,蒸馏法得到碘单质,
(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘;碘微溶于水,而碘离子易溶于水;
(2)分离互不相溶的液体采用分液的方法分离;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小;氯气、碘蒸气都能和氢氧化钠溶液反应生成无毒物质;
(4)①用ClO2氧化酸性含I-废液回收碘,是二氧化氯在酸溶液中氧化碘离子生成碘单质,二氧化氯被还原为氯离子,结合原子守恒、电荷守恒、电子守恒配平书写离子方程式;
②每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍.
解答 解:(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘离子,离子反应方程式为SO32-+I2+H2O=2I-+2H++SO42-;碘微溶于水,而碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子;
故答案为:SO32-+I2+H2O=2I-+2H++SO42-;使CCl4中的碘进入水层;
(2)四氯化碳属于有机物,水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法;
故答案为:分液;
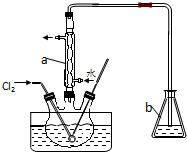
(3)碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;仪器a、b的名称分别为 球形冷凝管、锥形瓶,氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气,
故答案为:使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化); 球形冷凝管、锥形瓶;NaOH溶液;
(4)①用ClO2氧化酸性含I-废液回收碘,是二氧化氯在酸溶液中氧化碘离子生成碘单质,二氧化氯被还原为氯离子,ClO2~Cl-~5e-,2I-~I2~2e-,
反应的离子方程式为2ClO2+10I-+8H+=5I2+2Cl-+4H2O,
故答案为:2 ClO2+10 I-+8H+=5 I2+2 Cl-+4H2O;
②由氧化还原反应电子守恒,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,
故答案为:2.5.
点评 本题考查了有关SO2和NOx的知识,分析利用题干信息,明确物质的性质是解本题关键,根据物质的特殊性质、混合物分离和提纯方法的选取等方面来分析解答,知道碘的检验方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
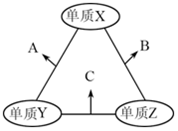 X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )| A. | 元素X,Z的单质均存在同素异形体 | B. | A和C溶于水,溶液均显碱性 | ||
| C. | A和B都可能具有漂白性 | D. | Z的氧化物的水化物一定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的熔点和沸点都很高 | B. | CCl4是含有极性键的非极性分子 | ||
| C. | HF、HCl、HBr、HI的稳定性依次增强 | D. | 第一电离能N<O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
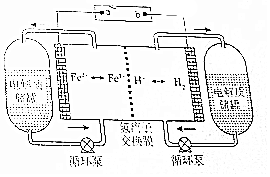 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )| A. | 充电时,a连接直流电源的正极 | |
| B. | 充电时,阴极的电极反应式为2Fe3++2e-═2Fe2+ | |
| C. | 放电时,右侧电解质储罐中的SO42-浓度逐渐增加 | |
| D. | 放电时,当转移0.1mol e-时,透过交换膜的离子有0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入过量的Ba(NO3)2溶液振荡,观察 | 现象:溶液中产生大量白色沉淀; 结论:试样中含有Na2CO3. |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入适量的NaOH溶液,振荡,观察 | 现象:有少量白色沉淀生成; 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中,先加入足量的稀硝酸,再加入少许AgNO3溶液振荡,观察 | 现象:有少量白色沉淀生成; 结论:试样中含有NaCl. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜既可以发生析氢腐蚀也可以发生吸氧腐蚀 | |
| B. | 铁只能发生析氢腐蚀 | |
| C. | 铜只能发生吸氧腐蚀 | |
| D. | 析氢腐蚀比吸氧腐蚀普遍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和C一定都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B和C不可能都是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应 C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 合成氨反应 N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快化学反应速率并提高转化率 | |
| C. | 甲烷和乙醇的燃烧热分别是 891.0 kJ/mol、1366.8 kJ/mol,利用甲烷更“低碳” | |
| D. | 氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转化率高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com