
| A. | 稀醋酸与氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 铜粉与稀硝酸反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与碘化钾溶液反应:Cl2+2I-═I2+2Cl- | |
| D. | 碳酸钙与足量盐酸反应:CO32-+2H+═H2O+CO2↑ |
分析 A.醋酸为弱电解质,要写为分子;
B.铜粉与稀硝酸反应生成NO;
C.氯气与碘化钾溶液反应生成单质碘和氯离子;
D.碳酸钙不溶于水,在离子反应中应保留化学式.
解答 解:A.醋酸为弱电解质,要写为分子,稀醋酸与氢氧化钠溶液反应:CH3COOH+OH-→CH3COO-+H2O,故A错误;
B.铜粉与稀硝酸反应生成NO,其反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故B错误;
C.氯气与碘化钾溶液反应生成单质碘和氯离子,其离子方程式为:Cl2+2I-═I2+2Cl-,故C正确;
D.盐酸与碳酸钙反应制备二氧化碳的离子反应为CaCO3+2H+=CO2↑+H2O+Ca2+,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,明确发生的化学反应是解答本题的关键,注意把握离子的反应必须符合反应的实际,注意电荷守恒和质量守恒问题,难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
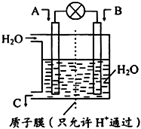 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是钠 | ||
| C. | 单质的与水反应时钠最剧烈 | D. | 原子半径逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加NaI溶液可以得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
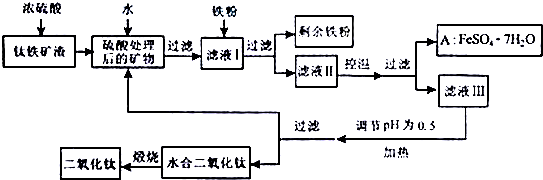
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
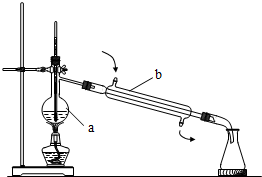 (1)写出如图所指仪器的名称:
(1)写出如图所指仪器的名称:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com