
在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡朝正反应方向移动
C.升高温度, 减小 D.加入NaOH固体,溶液pH减小
减小 D.加入NaOH固体,溶液pH减小
科目:高中化学 来源: 题型:
下列说法正确的是
A.氨水加水稀释后,溶液中c(NH3·H2O) /c(NH4+)的值减小
B.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
C.常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,则该反应的△H<0
D.相同条件下,Na2CO3溶液的碱性强于C6H5ONa,说明C6H5OH的酸性强于H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
分类思想以及用分类思想研究一类物质的通性和特殊性是学习化学的一种重要思维方式和手段。以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
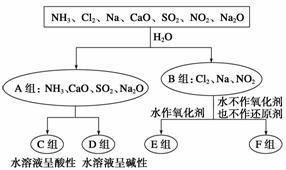
(1)上述第一级分类标准(分成A、B组的依据)是____________________。
(2)F组中物质除了Cl2外还有________(填化学式)。
(3)D组中的氨水呈弱碱性,用电离方程式表示其呈弱碱性的原因:
______________________________________________________________。
(4)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,用离子方程式说明理由:_______________________________________________________。
(5)FeCl3的水溶液滴入沸水可得到以Fe(OH)3为分散质的红褐色胶体
①该红褐色胶体中Z(OH)3粒子的直径大小范围是______________。
②FeCl3溶液滴入沸水可得到Fe(OH)3红褐色胶体的反应的离子方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下的反应N2(g)+ 3 H2(g) 2NH3(g) △H<0达到平衡,下列变化既能加快反应速率又能使平衡向正反应方向移动的是
2NH3(g) △H<0达到平衡,下列变化既能加快反应速率又能使平衡向正反应方向移动的是
A.升温 B.加压 C.减压 D.加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI>AgBr B.AgCl>AgBr>AgI
C.AgBr>AgCl>AgI D.AgBr>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2 N2O4 △H < 0,若把烧瓶置于100℃ 的沸水中,下列情况中不变的是
N2O4 △H < 0,若把烧瓶置于100℃ 的沸水中,下列情况中不变的是
A.气体的物质的量 B.压强 C.质量 D.密度
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA代表阿伏加德罗常数,下列说法正确的是
A.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA
B.标准状况下,11.2 L H2O 所含的分子数为0.5NA
C.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
D.18g H2O 和H2O2 的混合物含有的分子数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
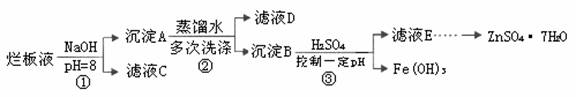
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH= a kJ•mol-1
Fe3+(aq)+3OH-(aq) ; ΔH= a kJ•mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH= b kJ•mol-1
H+(aq)+OH-(aq) ;ΔH= b kJ•mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com