
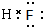 ;
;分析 A、B、C三种短周期元素,A-离子的电子层结构和氖原子相同,则A为F;短周期元素中金属性最强的是钠,则B是Na;C的原子核内质子数是B的次外层电子数的2倍,C质子数=8×2=16,所以C是S元素,据此进行解答.
解答 解:A、B、C三种短周期元素,A-离子的电子层结构和氖原子相同,则A为F;短周期元素中金属性最强的是钠,则B是Na;C的原子核内质子数是B的次外层电子数的2倍,C质子数=8×2=16,所以C是S元素,
(1)根据分析可知,A为F、B为Na、C为S元素,
故答案为:F;Na;S;
(2)A为F,其氢化物为HF,氟化氢为共价化合物,其分子中含有1个H-F键,氟化氢的电子式为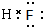 ,
,
故答案为: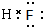 ;
;
(3)C为S,其最高价氧化物为SO3,氢氧化钠足量时,三氧化硫与氢氧化钠反应生成亚硫酸钠和水,反应的离子方程式为:SO3+2OH-=SO42-+H2O,
故答案为:SO3+2OH-=SO42-+H2O.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度不大,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题

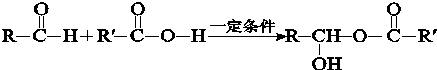

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Na与乙醇反应比与水反应更剧烈 | |
| B. | 在催化剂存在下,乙醇能被氧气氧化成乙醛 | |
| C. | 乙酸能与碳酸氢钠溶液反应放出CO2 | |
| D. | 在浓硫酸存在下加热,乙酸能与乙醇反应生成乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | CO2+NH3+H2O═NH4HCO3 | D. | 2Na2O2+2CO2═2Na2CO3+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求填空:
按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com