
| A. |  配制溶液 | B. |  碳酸氢钠受热分解 | ||
| C. |  制备乙酸乙酯 | D. |  制备收集干燥的氨气 |
分析 A.定容时改用胶头滴管,使液面与刻度线相切;
B.碳酸氢钠受热分解生成水,应防止水倒流;
C.乙酸乙酯制备中用饱和碳酸钠收集乙酸乙酯;
D.氨气的密度比空气小.
解答 解:A.定容时改用胶头滴管,使液面与刻度线相切,不能用烧杯加水,故A错误;
B.碳酸氢钠受热分解生成水,应防止水倒流,则试管口应略向下倾斜,故B错误;
C.乙酸乙酯制备中用饱和碳酸钠收集乙酸乙酯,饱和碳酸钠溶液抑制乙酸乙酯溶解、和乙酸反应、溶解乙醇,故C正确;
D.氨气的密度比空气小,选向下排空气法收集,则导管应伸到试管底部,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备、混合物分离提纯、溶液配制等,把握物质的性质、反应原理、实验基本操作为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
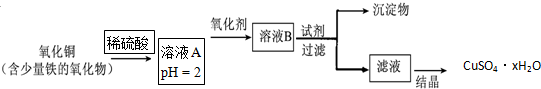

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验目的 | 操作 | 实验现象 | 结论 |
| 1检验Cl- | 取少许滤液于试管中,加入硝酸酸化的硝酸银溶液 | 有白色沉淀产生 | 含有Cl- |
| 2检验NH4+ | 取少许滤液于试管中,加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 | 石蕊试纸变蓝色 | 含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
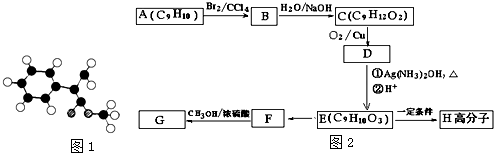
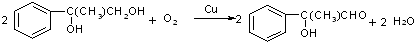 ;
;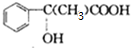 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
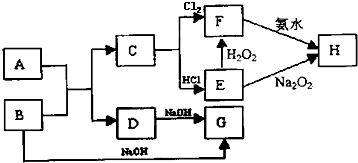
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
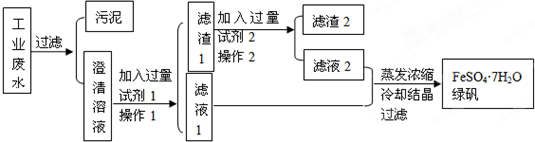
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验剩余的药品不能放回原试剂瓶 | B. | 酒精灯内酒精不能少于灯容积$\frac{1}{4}$ | ||
| C. | 实验结束后将试管清洗干净 | D. | 胶头滴管不能交叉使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com