
【题目】某待测溶液(阳离子为Na+)中只可能含有SO42-、SO32-、Cl-、Br-、NO3-、HCO3-中的一种或若干种,进行下列实验(每次实验所加试剂均足量):回答下列问题:
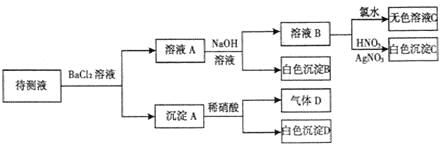
(1)待测液中是否含SO42-、SO32-离子__________________________________________
(2)气体D的化学式为____________,反应生成沉淀B的离子方程式为:____________
(3)根据以上实验,待测液中肯定没有的离子__________________________;肯定存在的离子是_____________________。
【答案】一定有 SO32-,而 SO42- 可能存在可能不存在 NO HCO3-+Ba2++OH-= BaCO3↓+H2O Br- HCO3-、SO32-
【解析】
待测液与氯化钡溶液反应生成沉淀A,则溶液中可能含有SO32-、SO42-,向沉淀中加入稀硝酸生成气体D,白色沉淀D,因为亚硫酸钡具有还原性,能够与硝酸反应生成硫酸钡和一氧化氮气体,而硫酸钡不溶于硝酸,所以溶液中一定存在SO32-,可能存在SO42-;滤液A中加入过量的NaOH溶液得到白色沉淀B,则溶液中一定含有HCO3-,白色沉淀B为BaCO3;滤液B中加入氯水,得无色溶液,溶液中一定不存在Br-;滤液B中加入硝酸银、硝酸溶液得到白色沉淀,白色沉淀为AgCl,说明滤液B中含有Cl-,因为加入氯化钡溶液,不能确定原溶液中是否含有Cl-;据以上分析解答。
待测液与氯化钡溶液反应生成沉淀A,则溶液中可能含有SO32-、SO42-,向沉淀中加入稀硝酸生成气体D,白色沉淀D,因为亚硫酸钡具有还原性,能够与硝酸反应生成硫酸钡和一氧化氮气体,而硫酸钡不溶于硝酸,所以溶液中一定存在SO32-,可能存在SO42-;滤液A中加入过量的NaOH溶液得到白色沉淀B,则溶液中一定含有HCO3-,白色沉淀B为BaCO3;滤液B中加入氯水,得无色溶液,溶液中一定不存在Br-;滤液B中加入硝酸银、硝酸溶液得到白色沉淀,白色沉淀为AgCl,说明滤液B中含有Cl-,因为加入氯化钡溶液,不能确定原溶液中是否含有Cl-;
(1)根据以上分析可以知道, 待测液中一定有 SO32-,而 SO42-可能存在可能不存在;
答案是: 一定有 SO32-,而 SO42-可能存在可能不存在;
(2)根据分析可以知道,气体D的化学式为NO;碳酸氢根离子与钡离子、氢氧根离子生成碳酸钡,反应生成沉淀B的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O;
答案是: NO;HCO3-+Ba2++OH-= BaCO3↓+H2O;
(3)根据分析可以知道,待测液中一定不存在的离子为Br-;肯定存在的离子为: HCO3-、SO32-;
答案是: Br-;HCO3-、SO32-。


科目:高中化学 来源: 题型:
【题目】在下列各溶液中,所给离子一定能大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.小苏打溶液:K+、SO42-、Cl-、H+
C.与铝反应产生H2的溶液中:Na+、K+、CO32-、Cl-
D.室温下,强酸性溶液中:Na+、Fe3+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加____g。
2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加____g。
(2)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。
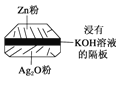
根据上述反应式,完成下列题目。
(1)下列叙述正确的是________。
A.在使用过程中,电解质KOH被不断消耗
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(2)写出电池的总反应式:___________________________________________________________。
(3)使用时,负极区的pH________(填“增大”“减小”或“不变”,下同),正极区的pH______,电解质溶液的pH________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时,立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激气味气体C通入澄清石灰水时变浑浊。
(1)A、B、C、D 的分子式分别为:
A_______________ B_______________C_______________D_______________
(2)写出下列各反应的化学方程式:
A与B______________________________________________
B与水____________________________________________
C与澄清石灰水______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是
A. CaO + H2O = Ca(OH)2 B. 3NO2 + 2H2O = 2HNO3+NO
C. 2H2O![]() 2H2↑+O2↑D. 2Na +2H2O =2NaOH+H2↑
2H2↑+O2↑D. 2Na +2H2O =2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~K有如图的转化关系,其中D、E为气体单质,A、H为常见金属。试回答(图中有些反应的产物和反应的条件没有全部标出):
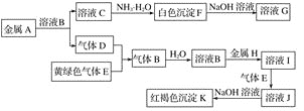
(1)写出下列物质的化学式:D是________, I是______。
(2)写出“C→F”反应的离子方程式:______________________________________。
(3)写出反应“J→K”的离子方程式:____________________________________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ag 硝酸钾溶于bg水,形成VmL饱和溶液。下列关系式错误的是( )
A. 该溶液的物质的量浓度:c(KNO3)=![]() mol·L-1
mol·L-1
B. 该溶液的质量分数:w(KNO3)=![]() %
%
C. 20 ℃时KNO3的溶解度S=![]() g
g
D. 该溶液的密度ρ=![]() g·L-1
g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温下,相同浓度的溶液碱性比较:![]()
B.常温下,往![]() 溶液中滴加稀盐酸至中性时,溶质的主要成分有
溶液中滴加稀盐酸至中性时,溶质的主要成分有![]() 、
、![]()
C.加热![]() 溶液至蒸干,可得到纯净的
溶液至蒸干,可得到纯净的![]() 固体
固体
D.常温下,若![]() 溶液中含有
溶液中含有![]() 可用
可用![]() 溶液鉴别
溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,理论上,加入NaOH的体积和所得沉淀的物质的量的示意图如下,b处NaOH的体积为1L,则下列判断正确的是
( )
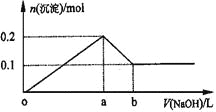
A.混合溶液中Al3+的物质的量为0.2mol
B.NaOH的浓度为0.5 mol/L
C.在b点处溶液中的溶质只有NaAlO2
D.图中线段oa:ab=5:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com