
【题目】25℃时,下列溶液中水的电离程度最小的是
A. pH=11的氨水 B. 0.01 mol/L的Na2CO3溶液
C. 0.01 mol/L的盐酸 D. pH=4的NaHSO3溶液
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A. 氢氧化钠溶液与稀醋酸反应:OH-+H+=H2O
B. 碳酸钙与足量稀硝酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
C. 氯化铝溶液与过量氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是( )
A. 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B. 若将CO2通入0.1mol/LNa2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液:c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是丁烷裂解的实验流程:(提示:丁烷在一定条件下裂解的可能方程式为:C4H10![]() C2H6+C2H4, C4H10
C2H6+C2H4, C4H10![]() CH4+C3H6)
CH4+C3H6)
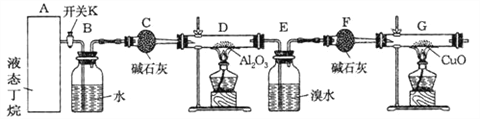
连接好装置后,需进行的实验操作有:
①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等…
(1)这三步操作的先后顺序依次是_______________________(填序号)
(2)写出甲烷与氧化铜反应的化学方程式______________________
(3)若对E装置中的混合物(溴水足量),再按以下流程实验:
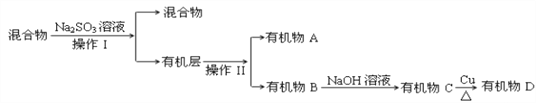
①分离操作Ⅰ和Ⅱ的名称分别是:Ⅰ________Ⅱ________,Na2SO3溶液的作用是(用离子方程式表示)________________________________________________________.
②已知B的碳原子数大于A的碳原子数,请写出B的结构简式_____________________.
(4)假定丁烷完全裂解,当(E+F)装置的总质量比反应前增加了0.7 g, G装置的质量减少了1.76 g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比 n(CH4): n(C2H6)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铅蓄电池的工作原理示意图,电池总反应式是Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O,则下列说法正确的是
2PbSO4+2H2O,则下列说法正确的是

A. 放电时:PbO2做负极
B. 充电时:硫酸浓度增大
C. 充电时:B应与电源的正极相连
D. 放电时:正极反应是Pb-2e-+SO![]() =PbSO4
=PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将赤铜矿(Cu2O)与辉铜矿(Cu2S)混合加热发生以下反应:2Cu2O+Cu2S![]() 6Cu+SO2↑,下列说法错误的是
6Cu+SO2↑,下列说法错误的是
A. 在Cu2O、Cu2S中Cu元素化合价都是+1价 B. 反应中Cu元素被氧化,S元素被还原
C. Cu2S在反应中既是氧化剂,又是还原剂 D. 每生成6.4gCu,反应中转移0.1mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氯化磷(PCl5)是有机合成中重要的氯化剂,易发生PCl5(s)![]() PCl3(g)+Cl2(g)反应。温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)反应。温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 相同条件下,起始时向容器中充入2.0 mol PCl5,PCl5的分解率增大
B. 只升高温度,平衡时c(PCl5)=0.12 mol/L,则正反应是放热反应
C. 反应在前50 s的平均速率v(PCl3)=0.0032 mol/(L·s)
D. 在密闭低温的条件下,有利于PCl5固体的保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世上万物、神奇可测,其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题。
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是_____(填字母)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为____,Q2+的未成对电子数是_____。
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①制元素在周期表中的位置是______,[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有______(填字母)。
A离子键 B金属键 C.配位键 D.非极性键 E极性键
③NH3中N原子的杂化轨道类型是______,写出一种与SO42-互为等电子体的分子的化学式:_ ______。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物.则[Cu(NH3)4]2+的空间构型为_________。
(4)氧与铜形成的某种离子晶体的晶胞如图所示。则该化合物的化学式为_____,如果该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____(用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com