
| A、已知HF的共价键键能比HCl大,说明稳定性:HF>HCl | ||||
| B、已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物 | ||||
C、已知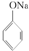 +SO2+H2O→ +SO2+H2O→ +Na2SO3,说明给出质子能力:HSO3->苯酚 +Na2SO3,说明给出质子能力:HSO3->苯酚 | ||||
D、已知CaCO3+SiO2
|
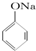 +SO2+H2O→
+SO2+H2O→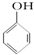 +Na2SO3,说明亚硫酸的酸性大于苯酚的酸性,苯酚和Na2SO3不反应说明HSO3-的酸性大于苯酚的酸性,因此给出质子能力:HSO3->苯酚,故C正确;
+Na2SO3,说明亚硫酸的酸性大于苯酚的酸性,苯酚和Na2SO3不反应说明HSO3-的酸性大于苯酚的酸性,因此给出质子能力:HSO3->苯酚,故C正确;
| ||


科目:高中化学 来源: 题型:
| A、Na2O2、Na2CO3 |
| B、NaOH、Na2CO3 |
| C、Na2CO3 |
| D、Na2O2、NaOH、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、锌作负极 |
| B、铜片上有气泡产生 |
| C、将电能转化为化学能 |
| D、锌片的电极反应式为:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| A、①④ | B、①③ | C、②③ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、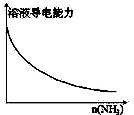 向一定量的CH3COOH溶液中通入NH3至过量 |
B、 向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量 |
C、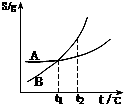 表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液升温至t2℃时,溶质的质量分数B=A |
D、 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量却并非是最大值 |
| B、将0.12mol Cl2通入到100mL 1mol/L的FeI2溶液中,离子方程式是:12Cl2+10Fe2++14I-→10Fe3++7I2+24Cl- |
| C、较高的温度下,可以测得0.1mol/L氨水的电离度为55%左右 |
| D、十六烷的裂化产物中不饱和烃的分子数可能会超过50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向硫酸亚铁溶液中通入H2S气体:Fe2++H2S→FeS↓+2H+ |
| B、碳酸钙溶于醋酸:CaCO3+2CH3COOH→Ca2++2CH3COO-+CO2↑+H2O |
| C、少量氢氧化钙溶液与碳酸氢钠溶液混合:OH-+HCO3-→H2O+CO32- |
| D、稀氯化铵溶液和澄清石灰水混合:NH4++OH-→NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
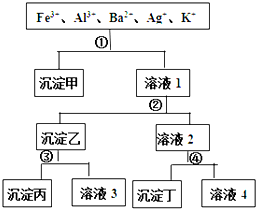 某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3?H2O、NaCl四种溶液,按如图所示的步骤分开五种离子.下列判断正确的是( )
某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3?H2O、NaCl四种溶液,按如图所示的步骤分开五种离子.下列判断正确的是( )| A、沉淀乙是氢氧化铝和氢氧化银的混合物 |
| B、溶液3中含有Al3+ |
| C、溶液4含有三种阳离子,分别是H+、Na+、K+ |
| D、试剂①是NaCl,试剂④是H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com