
下列说法或表示方法正确的是( )
A.反应物总能量低于生成物总能量,该反应不能发生
B.中和热一定是强酸跟强碱反应放出的热量
C.由石墨比金刚石稳定,可知C(石墨)==C(金刚石) ΔH>0
D.在101 kPa、25 ℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)==2H2O(l) ΔH=-285.8 kJ·mol-1
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:选择题
下列说法中不正确的是( )
A.1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L
B.1 mol臭氧和1.5 mol氧气含有相同的氧原子数
C.等体积、浓度均为1 mol/L的磷酸和盐酸,电离出的氢离子数之比为3∶1
D.等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1∶6,氧原子数之比为1∶3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:填空题
(每空3分,共6分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,写出表示硫的燃烧的热化学方程式:______________。
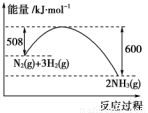
(2)如图是298 K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ·mol-1、1 411.0 kJ·mol-1和1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1 C.-330 kJ·mol-1 D.+330 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
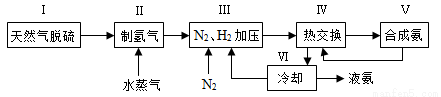
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:____________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 __。
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
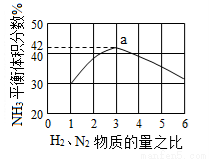
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)_____________。简述本流程中提高合成氨原料总转化率的方法:_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
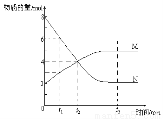
A.反应的化学方程式为: N == 2M
B.t2时,反应物和生成物的浓度相等,达到平衡
C.当M、N都是气体时增大压强,N物质的量减少
D.升高温度,平衡常数K增大,则反应的△H<0
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验过程中pH变化如图所示,下列有关叙述正确的是
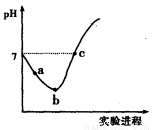
A.实验进程中可用pH试纸测定溶液的pH
B.a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
C.c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D.由a点到b点的过程中,溶液中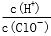 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.
含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com