
”¾ĢāÄæ”æļ®æÕĘųµē³Ų±Čļ®Ąė×Óµē³Ų¾ßÓŠøüøßµÄÄÜĮæĆÜ¶Č£¬Ē°¾°·Ē³£¹ćĄ«£¬Ęä½į¹¹¼°¹¤×÷ŌĄķČēĶ¼£Ø¹ĢĢåµē½āŅŗÖ»ŌŹŠķLi+Ķعż£©£¬ĻĀĮŠÓŠ¹ŲĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £© 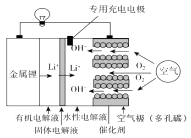
A.µē³Ų¹¤×÷Ź±£¬Õż¼«·“Ó¦Ź½£ŗO2+2H2O+4e©=4OH©
B.Č„µō¹ĢĢåµē½āŅŗŗĶÓŠ»śµē½āÖŹ£¬µē³Ų·“Ó¦·¢Éśøıä
C.³äµēŹ±£¬Éś³É14 g Li£¬æÕĘų¼«ÖŹĮæŌö¼Ó16 g
D.³äµēŹ±£¬×ØÓĆ³äµēµē¼«æÉŅŌÓŠŠ§·ĄÖ¹æÕĘų¼«øÆŹ“ŗĶĮÓ»Æ
”¾“š°ø”æC
”¾½āĪö”æ½ā£ŗA”¢ŅņĪŖøƵē³ŲĪŖĖ®ŠŌµē½āŅŗ£¬Õż¼«ÉĻŹĒŃõĘųµĆµē×ӵĻ¹Ō·“Ó¦£¬·“Ó¦ĪŖO2+2H2O+4e©=4OH© £¬ ¹ŹAÕżČ·£»
B”¢µē¼«·“Ó¦ŗĶµē½āÖŹ»·¾³ÓŠ¹Ų£¬Č„µō¹ĢĢåµē½āŅŗŗĶÓŠ»śµē½āÖŹ£¬µē³Ų·“Ó¦·¢Éśøı䣬¹ŹBÕżČ·£»
C”¢³äµēŹ±£¬Éś³É14 g Li£¬×ŖŅĘ2molµē×Ó£¬Õż¼«ÉĻŹĒŃõĘųµĆµē×ӵĻ¹Ō·“Ó¦£¬·“Ó¦ĪŖO2+2H2O+4e©=4OH© £¬ æÕĘų¼«ÖŹĮæŌö¼Ó34 gĒāŃõøłĄė×Ó£¬¹ŹC“ķĪó£»
D”¢³äµēŹ±£¬½įŗĻµē³ŲµÄ¹¹ŌģŗĶŌĄķ£¬²ÉÓĆ×ØÓĆ³äµēµē¼«æÉŅŌÓŠŠ§·ĄÖ¹æÕĘų¼«øÆŹ“£¬¹ŹDÕżČ·£®
¹ŹŃ”C£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ25”ę”¢101kPaĻĀ£¬1g¼×“¼Č¼ÉÕÉś³ÉCO2ŗĶŅŗĢ¬Ė®Ź±·ÅČČ22.68kJ£¬ĻĀĮŠČČ»Æѧ·½³ĢŹ½ÕżČ·µÄŹĒ£Ø £©
A.CH3OH£Øl£©+ ![]() O2£Øg£©ØTCO2£Øg£©+2H2O£Øl£©£»”÷H=+725.8 kJ/mol
O2£Øg£©ØTCO2£Øg£©+2H2O£Øl£©£»”÷H=+725.8 kJ/mol
B.2CH3OH£Øl£©+3O2£Øg£©ØT2CO2£Øg£©+4H2O£Øl£©£»”÷H=©1452 kJ/mol
C.2CH3OH£Øl£©+3O2£Øg£©ØT2CO2£Øg£©+4H2O£Øl£©£»”÷H=©725.8 kJ/mol
D.2CH3OH£Øl£©+3O2£Øg£©ØT2CO2£Øg£©+4H2O£Øl£©£»”÷H=+1452 kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚČõµē½āÖŹµÄĖµ·ØÖŠÕżČ·µÄŹĒ£Ø £©
A. Čõµē½āÖŹŠčŅŖĶصē²ÅÄÜ·¢ÉśµēĄė
B. “×ĖįČÜŅŗ“ļµ½µēĄėĘ½ŗāŹ±£¬²»“ęŌŚCH3COO£+H+![]() CH3COOH
CH3COOH
C. H2SO4ŹĒ¹²¼Ū»ÆŗĻĪļ£¬ĖłŅŌĖüŹĒČõµē½āÖŹ£»NaOHŹĒĄė×Ó»ÆŗĻĪļ£¬ĖłŅŌĖüŹĒĒæµē½āÖŹ
D. Čõµē½āÖŹČÜŅŗÖŠ£¬¼ČÓŠČÜÖŹ·Ö×Ó£¬ÓÖÓŠČÜÖŹµēĄė³öĄ“µÄĄė×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŹ¢ÓŠ×ćĮæMµÄĢå»żæɱäµÄĆܱÕČŻĘ÷ÖŠ¼ÓČėN£¬·¢Éś·“Ó¦£ŗM £Øs£©+2N £Øg£©ØT4P £Øs£©+Q£Øg£©”÷H£¼0£®ŌŚŅ»¶ØĪĀ¶Č”¢Ń¹ĒæĻĀ“ļµ½Ę½ŗā£¬Ę½ŗāŹ±PµÄĪļÖŹµÄĮæÓėĘšŹ¼Ź±¼ÓČėNµÄĪļÖŹµÄĮæµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©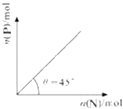
A.Ę½ŗāŹ±NµÄ×Ŗ»ÆĀŹĪŖ50%
B.µ±ĪĀ¶ČÉżøßŗó£¬ŌņĶ¼ÖŠ¦Č£¾45”ć
C.ČōŌŁ¼ÓČėN£¬ŌņÕż”¢Äę·“Ó¦ĖŁĀŹ¾łÖš½„Ōö“ó
D.ČōŌŚ¼ÓČėN£¬Ōņ·“Ó¦ĢåĻµÖŠĘųĢåĆÜ¶Č¼õŠ”
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆ¾”¢Ļ”ĻõĖį”¢³ĪĒåŹÆ»ŅĖ®”¢ĀČ»ÆĶČÜŅŗŹĒ֊ѧ»Æѧ֊µÄ³£¼ūĪļÖŹ£¬ĖÄÖÖĪļÖŹ¼äµÄ·“Ó¦¹ŲĻµČēĶ¼ĖłŹ¾£®Ķ¼ÖŠĮ½Ō²Ļą½»²æ·Ö£ØA£¬B£¬C£¬D£©±ķŹ¾ĪļÖŹ¼äµÄ·“Ó¦£¬ĘäÖŠ¶ŌÓ¦·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹéŠ“ÕżČ·µÄŹĒ£Ø £© 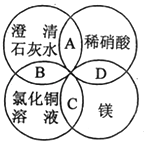
A.OH©+HNO3ØTH2O+NO ![]()
B.Ca£ØOH£©2+Cu2+ØTCa2++Cu£ØOH£©2
C.Mg+Cu2+ØTCu+Mg2+
D.Mg+2H+=Mg2++H2ӟ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓƵŖ»Æ¹čĢÕ“É“śĢę½šŹōÖĘŌģ·¢¶Æ»śµÄÄĶČČ²æ¼ž£¬Äܓ󷳶ČĢįøß·¢¶Æ»śµÄČČŠ§ĀŹ£®¹¤ŅµÉĻÓĆ»ÆѧĘųĻą³Į»ż·ØÖʱøµŖ»Æ¹č£¬Ęä·“Ó¦ČēĻĀ£ŗ3SiCl4£Øg£©+2N2£Øg£©+6H2£Øg£©![]() Si3N4£Øs£©+12HCl£Øg£©ŌŚĪĀ¶ČT0ĻĀµÄ2LĆܱÕČŻĘ÷ÖŠ£¬¼ÓČė0.30mol SiCl4 £¬ 0.20mol N2.0.36mol H2½ųŠŠÉĻŹö·“Ó¦£¬2minŗó“ļµ½Ę½ŗā£¬²āµĆ¹ĢĢåµÄÖŹĮæŌö¼ÓĮĖ2.80g
Si3N4£Øs£©+12HCl£Øg£©ŌŚĪĀ¶ČT0ĻĀµÄ2LĆܱÕČŻĘ÷ÖŠ£¬¼ÓČė0.30mol SiCl4 £¬ 0.20mol N2.0.36mol H2½ųŠŠÉĻŹö·“Ó¦£¬2minŗó“ļµ½Ę½ŗā£¬²āµĆ¹ĢĢåµÄÖŹĮæŌö¼ÓĮĖ2.80g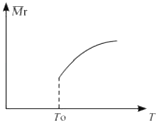
£Ø1£©SiCl4µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ
£Ø2£©Ę½ŗāŗó£¬ČōøıäĪĀ¶Č£¬»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæÓėĪĀ¶ČµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.øĆ·“Ó¦ŌŚČĪŗĪĪĀ¶ČĻĀæÉ×Ō·¢½ųŠŠ
B.Čō»ģŗĻĘųĢåµÄ×ÜÖŹĮæ²»±ä£¬±ķĆ÷ÉĻŹö·“Ó¦¼ŗ“ļµ½Ę½ŗāדĢ¬
C.ĘäĖūĢõ¼ž²»±ä£¬Ōö“óSi3N4µÄĪļÖŹµÄĮæ£¬Ę½ŗāĻņ×óŅʶÆ
D.°“3£ŗ2£ŗ6µÄĪļÖŹµÄĮæ±ČŌö¼Ó·“Ó¦Īļ£¬SiCl4£Øg£©µÄ×Ŗ»ÆĀŹ½µµĶ
£Ø3£©ĻĀ±ķĪŖ²»Ķ¬ĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£Źż£¬ĘäĖūĢõ¼žĻąĶ¬Ź±£¬ŌŚ£ØĢī”°T1”±”¢”°T2”±”¢”°T3”±£©ĪĀ¶ČĻĀ·“Ó¦“ļµ½Ę½ŗāĖłŠčŹ±¼ä×ī³¤£ŗ
ĪĀ¶ČT | T1 | T2 | T3 |
Ę½ŗā³£ŹżK | 1.2 | 2.5 | 10 |
¼ŁÉčĪĀ¶ČĪŖT1Ź±ĻņøĆ·“ӦȯĘ÷ÖŠĶ¬Ź±¼ÓČė£®c£ØSiCl4£©=0.3mol/L£¬c£ØH2£©=0.3mol/L£¬c£ØN2£©=x mol/L£¬c£ØHCl£©=0.3mol/LŗĶ×ćĮæSi3N4 £Øs£©£¬ČōŅŖŹ¹Ę½ŗā½ØĮ¢µÄ¹ż³ĢÖŠHClÅØ¶Č¼õŠ”£¬xµÄȔֵ·¶Ī§ĪŖ
£Ø4£©øĆ·“Ó¦µÄŌ×ÓĄūÓĆĀŹĪŖ
£Ø5£©¹¤ŅµÉĻÖʱøSiCl4µÄ·“Ó¦¹ż³ĢČēĻĀ£ŗ
¢ŁSiO2£Øs£©+2C£Øs£©ØTSi£Øs£©+2CO£Øg£©£¬”÷HØTakJ/mol
¢ŚSi£Øs£©+2Cl2£Øg£©ØTSiCl4£Øl£©£¬”÷H=bkJ/mol
¢ŪSiCl4£Øg£©ØTSiCl4£Øl£©£¬”÷HØTckJ/mol
Š“³ö¶žŃõ»Æ¹č”¢½¹ĢæÓėCl 2ŌŚøßĪĀĻĀ·“Ӧɜ³ÉĘųĢ¬SiCl4ŗĶŅ»Ńõ»ÆĢ¼µÄČČ»Æѧ·½³ĢŹ½ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĄė×Ó¼ģŃéµÄ·½·ØÕżČ·µÄŹĒ£Ø £©
A.ijČÜŅŗ¼ÓČėĻõĖįŅųČÜŅŗÓŠ°×É«³Įµķ£¬ĖµĆ÷ŌČÜŅŗÖŠÓŠCl©
B.ijČÜŅŗ¼ÓČėĀČ»Æ±µČÜŅŗÓŠ°×É«³Įµķ£¬ĖµĆ÷ŌČÜŅŗÖŠÓŠSO ![]()
C.ijČÜŅŗ¼ÓČėĒāŃõ»ÆÄĘČÜŅŗÓŠĄ¶É«³Įµķ£¬ĖµĆ÷ŌČÜŅŗÖŠÓŠCu2+
D.ijČÜŅŗ¼ÓČėĻ”ĮņĖįÉś³ÉĪŽÉ«ĘųĢ壬ĖµĆ÷ŌČÜŅŗÖŠÓŠCO ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌæÉÄę·“Ó¦4NH3£Øg£©£«5O2£Øg£© ![]() 4NO£Øg£©£«6H2O£Øg£©£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
4NO£Øg£©£«6H2O£Øg£©£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ
A. “ļµ½»ÆŃ§Ę½ŗāŹ±4vÕż£ØO2£©£½5vÄę£ØNO£©
B. Čōµ„Ī»Ź±¼äÄŚÉś³Éx mol NOµÄĶ¬Ź±£¬ĻūŗÄx mol NH3,Ōņ·“Ó¦“ļµ½Ę½ŗāדĢ¬
C. “ļµ½»ÆŃ§Ę½ŗāŹ±£¬ČōŌö“óČŻĘ÷ČŻ»ż£¬ŌņÕż·“Ó¦ĖŁĀŹ¼õŠ”£¬Äę·“Ó¦ĖŁĀŹŌö“ó
D. »Æѧ·“Ó¦ĖŁĀŹ¹ŲĻµ£ŗ2vÕż£ØNH3£©£½3vÕż£ØH2O£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»·¼ŗĶŖŹĒÖŲŅŖ»Æ¹¤ŌĮĻ£¬ŹĒÖĘŌģÄįĮś”¢¼ŗÄŚõ£°·ŗĶ¼ŗ¶žĖįµÄÖ÷ŅŖÖŠ¼äĢ壮ŹµŃéŹŅ³£ÓĆøõĖįŃõ»Æ»·¼ŗ“¼Öʱø£¬µ«øõĖį½Ļ¹óĒŅĪŪČ¾»·¾³£®Ä³»ÆѧŠĖȤŠĖȤŠ”×é³¢ŹŌÓĆ֊ѧ»Æѧøü³£¼ūµÄ“ĪĀČĖįÄĘ“śĢęøõĖįÖʱø»·¼ŗĶŖ£®ÓŠ¹ŲĪļÖŹŠÅĻ¢”¢ŹµŃéĮ÷³ĢČēĶ¼1¼°ŹµŃé×°ÖĆČēĶ¼2ČēĻĀ£ŗ»·¼ŗĶŖ£ŗĪŽÉ«»ņĒ³»ĘÉ«ĶøĆ÷ŅŗĢ壬ӊĒæĮŅµÄ“Ģ¼¤ŠŌ³ōĪ¶£¬Ļą¶ŌĖ®µÄĆÜ¶Č£ŗ0.95£¬ČŪµć£ŗ©45”ę£¬·Šµć£ŗ155”ę£¬Čܽā¶Č£Ø100mL H2O£©£ŗ2.4g £Ø31”ę £©£® »Ų“šĻĀĮŠĪŹĢā£ŗ
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŅĒĘ÷AµÄĆū³ĘŹĒ £®
£Ø2£©ŌŚ·“Ó¦æŖŹ¼µÄ5min£¬ĪŖĮĖ½«ĢåĻµĪĀ¶ČĪ¬³ÖŌŚ30”«35”ę£¬³żĮĖÓƱłĖ®Ō”ĄäČ“Ķā£¬²ÉČ”µÄ“ėŹ©»¹ÓŠ”¢ £®
£Ø3£©¼ÓČė±„ŗĶNaHSO3ČÜŅŗŹ±·¢ÉśµÄÖ÷ŅŖ·“Ó¦ŹĒ£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©£¬Č·±£¼ÓČėµÄ±„ŗĶNaHSO3ČÜŅŗŅŃ¾×ćĮæµÄŹµŃé²Ł×÷ŹĒ £®
£Ø4£©ĪŖ½«Įó³öŅŗµÄpHµ÷ÖĮÖŠŠŌ£¬æÉŅŌ¼ÓČėµÄŹŌ¼ĮŹĒ £®
A.Ļ”ŃĪĖį
B.ĪŽĖ®Ģ¼ĖįÄĘ
C.ÅØĮņĖį
D.ĒāŃõ»ÆÄĘ¹ĢĢå
£Ø5£©µ÷½ŚpHŗ󻹊č¼ÓČė¾«ÖĘŹ³ŃĪ£¬ĘäÄæµÄŹĒ £¬ ”°Č”ÓŠ»ś²ć”±Ź±Ź¹ÓƵÄÖ÷ŅŖŅĒĘ÷ŹĒ £® £ØĢīĶ¼3¶ŌÓ¦µÄ×ÖÄø£©£®
£Ø6£©ŹµŃéĢõ¼žµÄÓŻƶŌŹµŃé³É°ÜÖĮ¹ŲÖŲŅŖ£¬Š”×é³ÉŌ±¾õµĆÓŠ±ŲŅŖ¶ŌNaClOČÜŅŗµÄ×ī¼ŃÅØ¶Č½ųŠŠĢ½¾æ£®ĖūĆĒÅäÖĘĮĖŅ»ĻµĮŠ²»Ķ¬ÅØ¶ČµÄNaClOČÜŅŗ£¬²¢ÓƵĪ¶Ø·Ø±ź¶Ø£®¾ßĢå·½·ØŹĒ£ŗÓĆŅĘŅŗ¹ÜČ”10.00mL NaClOČÜŅŗÓŚ500mLČŻĮæĘæÖŠ¶ØČŻ£¬Č”25.00mLӌ׶ŠĪĘæÖŠ£¬¼ÓČėŹŹĮæĻ”ŃĪĖįŗĶKI¹ĢĢå£Ø×ćĮ棩£¬ÓĆ0.1000mol/L Na2S2O3±ź×¼ČÜŅŗµĪ¶ØÖĮÖÕµć£ØÓƵķ·ŪČÜŅŗ×÷ÖøŹ¾¼Į£©£¬Čż“ĪĘ½ŠŠŹµŃéĘ½¾łĻūŗÄNa2S2O3±ź×¼ČÜŅŗ18.00mL£¬ŅŃÖŖI2+2Na2S2O3ØT2NaI+Na2S4O6 £® ŌņøĆNaClOČÜŅŗµÄÅØ¶ČŹĒ £®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com