

| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成蓝色 | Cl2+2I-=I2+2Cl-(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl(用化学方程式表示) |
分析 (Ⅰ)A为金属单质; B为红褐色固体为Fe(OH)3;E为密度最小的气体为H2;G为浅绿色溶液为亚铁盐溶液,其中A、B、D、G含有同种元素,推断A为Fe,F为酸;
(Ⅱ)D为黄色溶液为铁盐溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,证明D为FeCl3,C为Cl2,
(Ⅲ)D味FeCl3能将某种氧化物氧化为F,上述分析F为酸,F是含有三种元素的化合物,推断F为H2SO4,G为FeSO4;
G为浅绿色溶液说明含有亚铁离子;D为黄色溶液,说明含有铁离子,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,说明含有氯离子,所以D是氯化铁;A是金属,A和C反应生成氯化铁,所以A是铁,C是氯气;氯化铁能转化为红褐色固体,所以B是氢氧化铁;F和铁反应生成氢气和亚铁盐,D能将某种氧化物氧化为F,说明该氧化物具有还原性,所以该氧化物是二氧化硫,二氧化硫和氯化铁反应生成硫酸,F是含有三种元素的化合物,所以F是硫酸,则G是硫酸亚铁,依据推断分析回答问题.
解答 解:(1)依据转化关系分析判断,一种单质和一种化合物反应生成另外的单质和化合物的化学反应是置换反应,反应②中氢气还原氧化铁生成铁属于置换反应,⑤中硫酸和铁反应生成硫酸亚铁和氢气属于置换反应,上述反应为②反应为3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O,⑤反应Fe+H2SO4=FeSO4+H2↑;
故答案为:②⑤;
(2)反应③是氯化铁溶液氧化二氧化硫发生的反应生成氯化亚铁和硫酸,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)D为FeCl3 溶液,与氨水反应的离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,故答案为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
(4)实验室制取C为Cl2,是利用二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
氯气有强氧化性,碘离子有还原性,所以二者能发生氧化还原反应生成碘单质,淀粉溶液遇碘变蓝色,所以看到的现象是溶液变蓝色,反应离子方程式为:Cl2+2I-=I2+2Cl-;继续通入氯气,氯气能氧化碘单质生成碘酸,导致溶液褪色,所以看到的现象是溶液褪色,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 蓝 | Cl2+2I-=I2+2Cl- | |
| 5Cl2+I2+6H2O=2HIO3+10HCl |
点评 本题以物质推断为载体考查了元素化合物的性质,以“D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀”为题眼来正确推断物质是解本题的关键,注意铁离子能把二氧化硫氧化呈硫酸不是三氧化硫,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
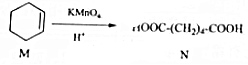 ,下列有关说法中正确的是( )
,下列有关说法中正确的是( )| A. | M中所有碳原子均位于同一平面,且与苯互为同系物 | |
| B. | 与N含有相同官能团的同分异构体共有8种 | |
| C. | M能发生加成反应和取代反应 | |
| D. | N与乙醇发生酯化反应,生成物的分子式一定为C8H14O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下,纯水pH=6,该温度下1L pH=10的氨水中含有OH-数目为0.01NA | |
| B. | 0.1mol•L-1的AlCl3溶液与NaOH溶液反应所得产物中含Al为0.1NA | |
| C. | 足量的Zn与浓硫酸共热可生成标准状况下的气体2.24L,则参加反应的硫酸为0.4NA | |
| D. | 42gC3H6和C4H8的混合气体中含有共价键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
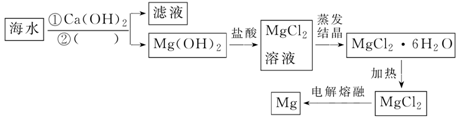
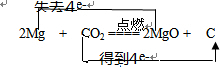 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子半径 | 得电子能力 | 酸性 | 金属性 |
| Cl->Al3+ | 16O=18O | H2CO3>H2SiO3 | Cu<Al |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,X的电子式是
,X的电子式是 ,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,B转化为C的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
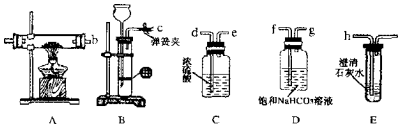
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
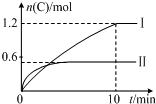 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
| Ⅱ | 800℃ | 1.5mol | 0.5mol | ─ |
| A. | a=-160 | |
| B. | 600℃时,该反应的平衡常数是0.45 | |
| C. | 实验Ⅰ中,10min内平均速率v(B)=0.06mol•L-1•min-1 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com