
| A、其他条件不变时,升高温度,化学反应速率加快 |
| B、其他条件不变时,增大浓度,化学反应速率加快 |
| C、化学反应达到反应限度时,反应物的浓度与生成物的浓度相等 |
| D、化学反应达到反应限度时,正反应的速率与逆反应的速率相等 |


科目:高中化学 来源: 题型:

| 离子 | 开始沉沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关该氢氧燃料电池的说法错误的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关该氢氧燃料电池的说法错误的是( )| A、该电池工作时将化学能转化为电能 |
| B、电流从电极b经外电路流向电极a |
| C、该电池中的电极b是正极 |
| D、在电极a上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cu+2H2SO4(浓)
| ||||
B、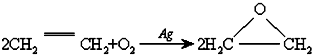 | ||||
| C、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O | ||||
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物 质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com