
设NA代表阿伏加德罗常数的数值,下列说法正确的是:
A.10 mL 20 mol·L-1浓硫酸与足量锌反应,转移电子数为0.2NA
B.0.1 mol24Mg18O晶体中所含中子总数为2.0 NA
C.在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA
D.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
科目:高中化学 来源:2014-2015湖南省娄底市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列各步反应A(HCl)→B(Cl2)→C〔Ca(ClO)2〕→D(HClO)→E(CO2),其中不能够直接实现的化学反应是
A.A→B B.B→C C.C→D D.D→E
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省清远市高三上学期期末理综化学试卷(解析版) 题型:选择题
常温下,下列有关物质的量浓度关系正确的是
A.等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH
B.pH相同的溶液中:c(Na2CO3)<c(NaHCO3)
C.在Na2SO3溶液中:c(Na+) = 2c(SO32— ) + c(HSO3— ) + c(OH— )
D.0.1mol·L—1NaHS溶液中:c(Na+) = c(HS-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:填空题
【选修3—物质结构与性质】(14分)
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道。请回答下列问题:
(1)R原子的基态电子排布式为 。
(2)X、Y原子的第一电离能大小顺序为 。(用元素符号表示)
(3)X的常见单质分子结构中σ键数目为 。
(4)Z的最高价氧化物对应水化物的酸根离子空间构型为 ,中心原子的杂化轨道类型为 。
(5)某矿物晶体由Y、W、R三种元素组成,其晶胞结构如图所示。

则该矿物的化学式为 ,若已知该晶胞的边长为a cm,则该晶胞的密度为 g/cm3。(用含a、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是:
A.将过量SO2气体通入氨水中:SO2+2 NH3·H2O =2 NH4+ + SO32-+H2O
B.向FeI2溶液中通入足量的氯气:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
C.向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3- = BaCO3↓+2H2O+ CO32-
D.硝酸铁溶液中滴加足量HI溶液:Fe3+ + 3NO3-+12H+ +10I- = Fe2+ + 5I2 + 3NO↑ + 6H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
向含S2—、Fe2+、Br—、I—各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是 :

查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
欲证明一瓶无色液体是纯水,可靠的实验方法是:
A.测得其pH=7
B.电解时得到H2与O2的体积比为2:1
C.遇钠生成氢气
D.1.01× 105Pa时沸点为100℃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:实验题
(14分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:实验原理是
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C. 将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
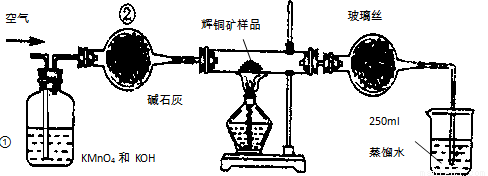
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是__________(写一种即可)。
(5)已知在常温下FeS 的 Ksp= 6.25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) = 1.0×10-22 。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________。
(6)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式______.
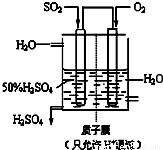
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是

A. 图1所示的总反应为吸热反应。
B. 图2所示实验为用0.01 mol·L-1的HCl溶液滴定20 mL 0.01 mol·L-1的NaOH溶液。
C. 图3可以表示反应CO(g)+2H2(g) CH3OH(g)的平衡常数K随压强p变化的关系。
CH3OH(g)的平衡常数K随压强p变化的关系。
D. 图4可以表示常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com