
选考【化学---选修2:化学与技术(15分)】
MgSO4·7H2O在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
温度/ ℃ | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)沉淀C的化学式是
(2)过滤Ⅲ需趁热过滤的理由是
(3)操作Ⅰ和操作Ⅱ的名称分别为 、
(4)滤液I中加入硼镁泥,调节溶液的pH=5~6,可除去滤液Ⅰ中 (填离子符号);加入NaClO溶液加热煮沸,可将Fe2+氧化成Fe3+的同时,还会将溶液中的Mn2+氧化成MnO2,写出Mn2+被氧化成MnO2的离子反应方程式为
(5)硼镁泥是硼镁矿生产硼砂(Na2B4O7·10H2O)时的废渣。将硼镁矿(Mg2B2O5·H2O)煅烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。此反应为熵减小反应,试写出反应方程式
(15分)
(1)CaSO4·2H2O或CaSO4 (2分)
(2)以防MgSO4在温度低时结晶析出(2分)
(3)蒸发浓缩 冷却结晶(各2分,共4分)
(4) Fe3+、Al3+(2分) Mn2++ClO-+H2O=MnO2↓+2H++Cl-(2分)
(5)2Mg2B2O5+Na2CO3+3CO2+10H2O=Na2B4O7·10H2O +4MgCO3(3分)
【解析】
试题分析:(1)根据化学流程和溶解性表中的数据,CaSO4在较高温度时溶解度较小,所以趁热过滤Ⅲ所得的沉淀C为:CaSO4·2H2O或CaSO4。
(2)温度较高时MgSO4的溶解度比较大,随着温度降低,MgSO4的溶解度逐渐减小,所以过滤Ⅲ需趁热过滤,以防MgSO4在温度低时结晶析出。
(3)由MgSO4溶液制取MgSO47H2O,应依次进行蒸发浓缩、冷却结晶、过滤等操作。
(4)滤液I中含有Fe3+、Fe2+、Al3+、Mg2+,根据阳离子以氢氧化物形式完全沉淀时溶液的pH数据,调节溶液的pH=5~6,Fe3+转化为Fe(OH)3沉淀,Al3+转化为Al(OH)3沉淀,所以可除去滤液Ⅰ中Fe3+、Al3+;根据题目所给信息,ClO在H2O存在的条件下,把Mn2+氧化为MnO2,同时生成H+、Cl,配平可得离子方程式:Mn2++ClO-+H2O=MnO2↓+2H++Cl-。
(5)根据题目所给信息和元素守恒,该反应的反应物有Mg2B2O5、Na2CO3、CO2、H2O,生成物有Na2B4O7·10H2O和MgCO3,配平可得化学方程式:2Mg2B2O5+Na2CO3+3CO2+10H2O=Na2B4O7·10H2O +4MgCO3。
考点:本题考查化学流程的分析、基本操作、方程式的书写。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2014-2015安徽省淮南市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
25 ℃、101 kPa下:①2Na(s)+  O2(g)===Na2O(s);ΔH1=-414 kJ/mol
O2(g)===Na2O(s);ΔH1=-414 kJ/mol
②2Na(s)+O2(g)===Na2O2(s);ΔH2=-511 kJ/mol
下列说法正确的是
A.①和②产物中的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)===2Na2O(s) ; ΔH=-317 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
常温下,把pH=2的H2SO4和pH=11的NaOH溶液混和,若使混和液pH=7,则酸与碱溶液的体积比是
A.10:1 B.1:10 C.1:2 D.2:1
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
把A、B、C、D四块金属泡在稀硫酸中,用导线两两相连可以组成各种原电池,若A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极。则四种金属的活泼性顺序由大到小排列为
A.A>B>C>D B.A>C>B>D
C.A>C>D>B D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液:c(H+)= c(OH-)= c(NH )=c(Cl-)
)=c(Cl-)
B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
D.常温下,pH=2的CH3COOH与pH=12的NaOH等体积混合:c (CH3COO-)+ c(H+)>c(Na+)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:


(1)反应
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
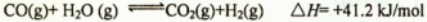
①下列事实能说明该反应达到平衡的是 ,
a.体系中的压强不发生变化
b.
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= 。
③向平衡体系中充入少量CO则平衡常数____(填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三第二次质检理综化学试卷(解析版) 题型:选择题
某有机高分子由 、-CH2-CH2-两种结构单元组成,且它们自身不能相连,该烃分子中C、H两原子物质的量之比是
、-CH2-CH2-两种结构单元组成,且它们自身不能相连,该烃分子中C、H两原子物质的量之比是
A.2︰1 B.8︰7 C.2︰3 D.1︰1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.用白醋除铁锈:Fe2O3·xH2O + 6H+ = (3+x)H2O + 2Fe3+
B.用强碱溶液吸收工业制取硝酸尾气: NO + NO2 + 2OH-= 2NO3- + H2O
C.将少量SO2气体通入氨水中:SO2 + NH3·H2O=NH4+ + HSO3-
D.向稀硫酸中加入少量Ba(OH)2溶液:2H++ SO42-+ Ba2++ 2OH-= BaSO4↓ + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com