
 Cr��OH��3+3H+����Һ��H+�ŵ磬c��H+���½���ƽ�������ƶ���ʹCr3+�γ�Cr��OH��3���������������Һ��c��Fe3+��Ϊ1.3��10-13mol/L������Һ��Cr3+Ũ��Ϊ3.0��10-5mol/L��
Cr��OH��3+3H+����Һ��H+�ŵ磬c��H+���½���ƽ�������ƶ���ʹCr3+�γ�Cr��OH��3���������������Һ��c��Fe3+��Ϊ1.3��10-13mol/L������Һ��Cr3+Ũ��Ϊ3.0��10-5mol/L�� ���� ��1���ٷ�Ӧ��Oԭ�ӻ��ϼ��ɹ���������-1������Ϊ������0�ۣ�MnԪ�ػ��ϼ��ɸ��������+7�۽���Ϊ��������+2�ۣ�����OԪ�ػ��ϼ۱仯����ת�Ƶ��ӣ�
�������ĸ�����ص����ʵ��������ݵ���ת���غ��������������ʵ������������������������������
�ڹ�������ֽ�����ˮ����������������˵�����ȶ��ԣ�
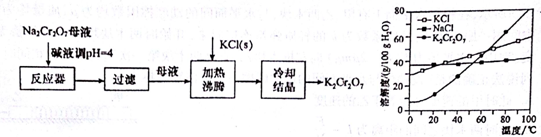
��2��������ҺpH��Fe3+ת��Ϊ�����������������˳�ȥ����Һ�м���KCl�����������Ũ�ȣ�������K2Cr2O7�ܽ�����Լ�С����ȴ����K2Cr2O7��
��3��������Ŀ��Ϣ��֪������������Fe2+��Cr2O7 2-��Ӧ����Fe3+��Cr3+��
�ڴ���ƽ��Cr3++3H2O
��Ksp[Fe��OH��3]=c��Fe3+����c3��OH-����Ksp[Cr��OH��3]=c��Cr3+����c3��OH-���������㣮
��� �⣺��1���ٷ�Ӧ��Oԭ�ӻ��ϼ��ɹ���������-1������Ϊ������0�ۣ�MnԪ�ػ��ϼ��ɸ��������+7�۽���Ϊ��������+2�ۣ�ÿ����1molO2����Ӧת�Ƶ��ӵ����ʵ���Ϊ1mol��2��[0-��-1��]=2mol��
���ݵ���ת���غ㣬�ɵã�5n��KMnO4��=2n��H2O2������250mL��Һ��H2O2��������Cmol/L��V��10-3L��$\frac{5}{2}$��$\frac{250mL}{25mL}$��34g/mol�������������������Ϊ��[��Cmol/L��V��10-3L��$\frac{5}{2}$��$\frac{250mL}{25mL}$��34g/mol���£�10.00mL����g/mL��]��100%=$\frac{8.5CV}{��}$%��
�ʴ�Ϊ��2mol��$\frac{8.5CV}{��}$%��
����֤H2O2�IJ��ȶ��ԣ������ǣ�ȡ��������������Һ���Թ��м��ȣ��Ѵ����ǵ�ľ�������Թܣ�ľ����ȼ��
�ʴ�Ϊ��ȡ��������������Һ���Թ��м��ȣ��Ѵ����ǵ�ľ�������Թܣ�ľ����ȼ��
��2����ĸҺ�м���������ҺpH��Fe3+ת��Ϊ�����������������˳�ȥ����Һ�м���KCl�����������Ũ�ȣ�������K2Cr2O7�ܽ��ԶС��������֣����¶ȵĽ��ͣ�K2Cr2O7�ܽ�����Լ�С����ȴ����K2Cr2O7����Ӧ���ӷ���ʽΪ��Na2Cr2O7+2KCl=K2Cr2O7+2NaCl��
�ʴ�Ϊ����ȥFe3+�� Na2Cr2O7+2KCl=K2Cr2O7+2NaCl��������K2Cr2O7�ܽ��ԶС��������֣����¶ȵĽ��ͣ�K2Cr2O7�ܽ�����Լ�С��
��3��������Ŀ��Ϣ��֪������������Fe2+��Cr2O7 2-��Ӧ����Fe3+��Cr3+����Ӧ���ӷ���ʽΪ��6Fe2++Cr2O7 2-+14H+=2Cr3++6Fe3++7H2O��
�ʴ�Ϊ��6Fe2++Cr2O7 2-+14H+=2Cr3++6Fe3++7H2O��
�ڴ���ƽ��Cr3++3H2O
��Ksp[Fe��OH��3]=c��Fe3+����c3��OH-����Ksp[Cr��OH��3]=c��Cr3+����c3��OH-������֪c��Cr3+��=$\frac{Ksp[Cr��OH��_{3}]��c��F{e}^{3+}��}{Ksp[Fe��OH��_{3}]}$=$\frac{6.0��1{0}^{-31}��1.3��1{0}^{-13}}{2.6��1{0}^{-39}}$mol/L=3.0��10-5mol/L��
�ʴ�Ϊ������ƽ��Cr3++3H2O
���� ���⿼��������ԭ�ζ�����㡢��ѧ�������̡����ʷ����ᴿ���ܶȻ��йؼ��㡢ƽ���ƶ��ȣ�����ƴ������Ŀ�����ضԻ�ѧԭ���Ŀ��飬�������ʷ����ᴿ���÷�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2412Mg��2612Mg | B�� | O2��O3 | C�� | NO��NO2 | D�� | H2O��H2O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �������� | Fe��OH��3 | Fe��OH��2 | Ni��OH02 |
| ��ʼ������pH | 1.5 | 6.5 | 7.7 |
| ������ȫ��pH | 3.7 | 9.7 | 9.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ʼ��� | B�� | ������ | C�� | ������ | D�� | ���ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ������Ϊ
������Ϊ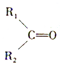 ��
�� ��R1��R2��R3��R4��ʾ��������ԭ�ӣ����ɴ��ƶϷ���ʽΪC5H10��ϩ�����п��ܵ����������У�������
��R1��R2��R3��R4��ʾ��������ԭ�ӣ����ɴ��ƶϷ���ʽΪC5H10��ϩ�����п��ܵ����������У�������| A�� | 5�� | B�� | 6�� | C�� | 7�� | D�� | 8�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | B���⻯��ķе��D���⻯��Ҫ�ߣ�ԭ����B�ķǽ�����ǿ | |
| B�� | �Ƚ�A��CԪ���γɵij�����������ǵĻ�ѧ��������ͬ����������Ҳ��ͬ | |
| C�� | C������������ˮ�������Ա�D������������ˮ��������ǿ | |
| D�� | ����Ԫ�������ɣ��Ʋ�E��������ȼ��ʱ��������E2O2��EO2������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | Y������������Ӧˮ��������Ա�X���� | |
| B�� | Zλ��Ԫ�����ڱ��еڶ����ڣ��ڢ�A�� | |
| C�� | X����̬�⻯����ȶ��Ա�Z���� | |
| D�� | M��ԭ�Ӱ뾶��Y��ԭ�Ӱ뾶�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �������� | Fe��OH��3 | Fe��OH��2 | Al��OH��3 | Ni��OH��2 |
| ��ʼ������pH | 1.1 | 6.5 | 3.5 | 7.1 |
| ������ȫ��pH | 3.2 | 9.7 | 4.7 | 9.2 |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com